RUTA A LA VACUNA COVID-19
1. TRATAMIENTOS TERAPÉUTICOS EN ESTUDIO CONTRA EL COVID-19
2. FUNDAMENTOS DE LA VACUNA: CÓMO DESARROLLAMOS LA INMUNIDAD
3. RESPUESTA INMUNE
4. DESARROLLO DE VACUNAS
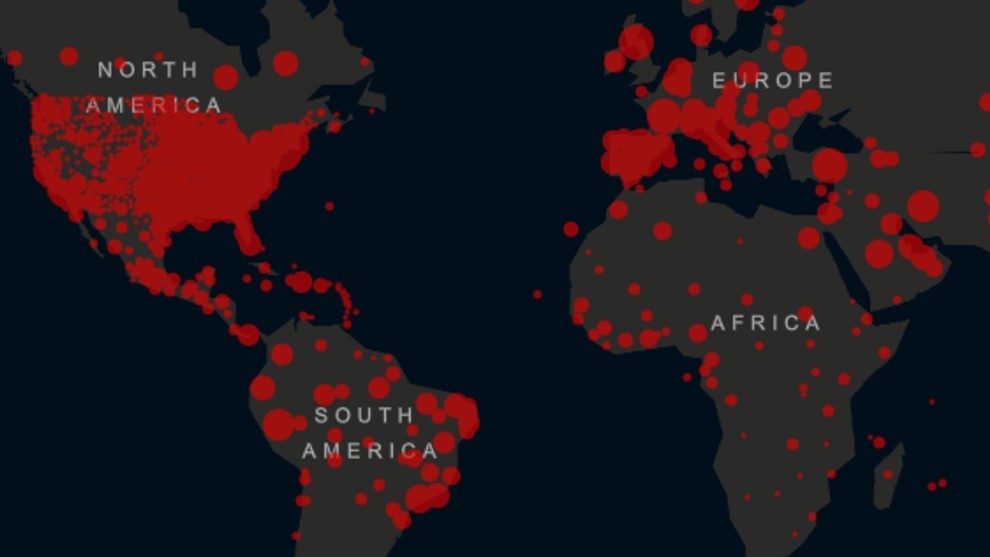
Figura 1. Fuente:
Universidad Johns Hopkins (Baltimore, EE.UU.), actualizado al 26 de mayo 2020
19:15 GMT.
La reciente
pandemia del síndrome
respiratorio agudo severo –coronavirus 2 (SARS-CoV-2) ha exigido que los
científicos estén reconstruyendo rápidamente evidencia sobre el cómo este nuevo
coronavirus ataca, cuál es su origen y, sobre todo, el cómo combatirlo, lo
cierto es que existen esas y muchas otras incógnitas de carácter urgente por
resolver. David Cyranoski señala que las enfermedades causadas por la familia
de coronavirus fue documentada desde 1912 por veterinarios alemanes, quienes confirmaron
que los coronavirus eran la causa de bronquitis en pollos y afectaciones graves
en los intestinos en cerdos, enfermedad que mató a casi todos los lechones en
menos de dos semanas. Hasta entonces no se había reportado el vínculo entre los
patógenos que causaron estas enfermedades. Fue en 1960, que investigadores en
el Reino Unido y los Estados Unidos, aislaron dos virus con estructuras en
forma de corona que causan resfriados comunes en humanos; y en 1968 se acuñó el
término coronavirus para todo el grupo viral con esa estructura típica, debido
a su mortalidad en diversas especies animales estos virus fueron considerados “una
familia de asesinos dinámicos”, ya que el coronavirus de los perros podían
dañar a los gatos, o el corvirus de los gatos dañaba los intestinos de los
cerdos. En humanos se creyó que estos coronavirus solo causaban daños leves, fue
hasta el 2003 con el brote del síndrome respiratorio agudo severo (SARS) que se
evidenció la letalidad de estos virus en personas. Por lo que la reciente
pandemia de COVID-19 no es la excepción, las cifras crecientes de muertos por
esta enfermedad ponen al SARS-CoV-2 en el perfil de asesino número uno de esta
familia de coronavirus, debido ha que este ha desarrollado una serie de
adaptaciones que lo hacen mucho más letal
[1]. De acuerdo al reporte de la Universidad Johns
Hopkins (Baltimore, EE.UU.) actualizado en tiempo real en la URL: https://us.marca.com/claro/mas-trending/2020/05/18/5ec29347268e3ec9708b45d6.html, hasta el momento la pandemia ha dejado un total de 5,519,878
contagios y 346,700 muertes (26 de mayo 2020 19:15 GMT), distrubuído en 188
países. De acuerdo a la OMS, en el continente Américano el número
de casos acumulados de contagios de COVID-19 es de 2,454,452 y 138,116 muertes
a la fecha.
Lo cierto es que el SARS-CoV-2, ha
venido a reinventar la epidemiología moderna, poniendo desafíos científicos en
el desarrollo de métodos para la oportuna detección del SARS-CoV-2 y la
búsqueda de respuestas para mitigar la enfermedad del COVID-19 y los síntomas causado
por este coronavirus. Sin embargo, la evidencia y pronósticos apuntan a que el SARS-CoV-2 llegó para quedarse haciando cambios definitivos en el estilo de nuetras vidas. De acuerdo con
Sarah Cobey del Department of Ecology & Evolution, de la University of
Chicago, no existe precendente de la pandemia actual en la historia moderna, sin
embargo, el comportamiento de este patógeno y la alta tasa de transmisión sugiere
que esta enfermedad continuará causando afectaciones sociales y en la salud,
hasta que haya una vacuna disponible.
1. TRATAMIENTOS
TERAPÉUTICOS EN ESTUDIO CONTRA EL COVID-19
El uso de fármacos se emplea cuando la
carga microbiana está llegando a su punto máximo y cuando los signos clínicos
son más evidentes. En contraste, las vacunas y los anticuerpos generalmente
protegen en el primer encuentro con un patógeno, puede ser antes de presentar
síntomas o cuando el número de microorganismos aún es muy bajo
[2]
.
En países como China y Estados Unidos, ensayos
clínicos para combatir el SARS-CoV-2 se están realizando ininterrumpidamente. Por ejemplo, se estudia el uso de antivirales eficaces en otros miembros de la familia de coronavirus probados en
modelos animales, y que puedan ser candidatos potenciales para combatir el
SARS-CoV-2, debido a que son coronavirus
estrechamente relacionados
[3,4]. Uno de los agentes
terapéuticos ampliamente estudiado es el Remdesivir (RDV, GS-5734), un profármaco monofosforamidato con actividad antiviral
demostrada contra diversas familias de virus de ARN
[4]
. También el uso de dos
inhibidores de VIH autorizados, el lopinavir y ritonavir, están siendo
probandos en ensayos clínicos
[5]. La combinación de ambos
antivirales se utilizó como
tratamiento para el SARS-CoV-1 en 2003-2004
[6].
Sin embargo, el desarrollo de una vacuna
parece ser el objetivo clave en estos momentos, y para tiempos futuro la
prevención de contagios por COVID-19, no obstante, el desarrollo de una vacuna
contra el SARS-CoV-2 y su proceso de producción es un desafío científico, además,
una vez disponible la vacuna debe ser bien conocida la epidemiología del
patógeno y la durabilidad de la inmunidad al SARS-CoV-2 para poder guiar las estrategias
de vacunación
[7]
.
De acuerdo con Charles Schmidt el desafío para desarrollar una vacuna inició unos pocos
días después de que se confirmó que el genoma del SARS-CoV-2 era diferente al
de su antecesor el SARS en 2003 y, por lo tanto, no existía la inmunidad para
este nuevo coronavirus, lo que representa el mayor desafío para la salud y la
prosperidad mundial desde la Segunda Guerra Mundial. Dan Barouch director del
Centro de Investigación de Virología y Vacunas en el Centro Médico Beth Israel
Deaconess y profesor de medicina en la Facultad de Medicina de Harvard
desarrolló una vacuna en colaboración con Janssen Pharmaceutical Cos., para la
cual buscan empezar los ensayos clínicos para el otoño. Lo cierto es que todos
los grupos de investigación "queremos avanzar lo más rápido posible,
porque creemos que el mundo necesita una vacuna", dijo Barouch https://news.harvard.edu/gazette/story/2020/04/harvards-coronavirus-vaccine-efforts/. De acuerdo a lo reportado con Ewen
Callaway, actualmente equipos de investigación, empresas y universidades de
todo el mundo están desarrollando más de 90 vacunas contra el SARS-CoV-2, donde
se están empleando novedosas tecnologías en estudios sin presendentes para una
vacuna autorizada.
2. FUNDAMENTOS DE LA VACUNA:
CÓMO DESARROLLAMOS LA INMUNIDAD
INFECCIÓN
DEL SARS-CoV-2 EN NUESTRO ORGANISMO
El SARS-CoV-2 presenta una estructura
típica caracterizada por tener organizadas en forma de corona, un conjunto de proteínas
espiga (S) glucosiladas que sobresalen de la superficie viral. Estas proteinas
S tienen una afinidad muy alta para unirse con la enzima convertidora de
angiotensina 2(ACE2) humana para poder ingresar a las células del huesped
[8].
La proteína S (considerada dominio de
unión al receptor) comprende las subunidades S1 y S2 en cada monómero de púas,
y media la interacción con las células del huesped. Es por ello, que esta proteína
es el objetivo principal de los anticuerpos neutralizantes después de la
infección y el foco del diseño terapéutico y de la vacuna, debido a que se
encuentra expuesta en la superficie y media la entrada en las células
[9]
. Esta glucoproteína al unirse en la
envoltura a los receptores de la célula huésped desencadena eventos de fusión
entre las membranas celulares y virales, es una proteasa del propio huesped
corta la espiga y permite la entrada del virus
[10,11]
.
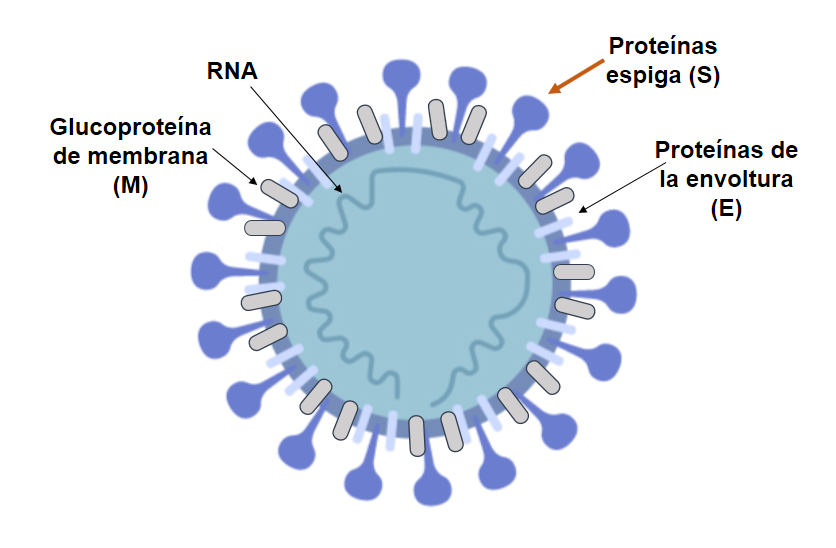
Figura 2. Estructura típica del
SARS-CoV-2.
A continuación presentamos un esquema
general sobre los modelos estudiados en el desarrollo de una vacuna contra el SARS-CoV-2
propuesto por Ewen Callaway y diseñado por Nik Spencer
[12]
. En el primer apartado observamos la
fase de infección del SARS-CoV-2 a una
célula huesped en humanos para poder reproducirse.
1. El virus entra al cuerpo
2. El virus entra en una célula huésped
3. El virus se fusiona con la vesícula y se libera su ARN.
4. Ensamblaje del virus
5. Liberación de virus
 12.41.30.png)
Figura 3.
Infección del SARS-CoV-2 en el huesped.
3. RESPUESTA INMUNE
El
sistema inmunitario adaptativo del cuerpo puede aprender a reconocer nuevos
patógenos invasores, como el coronavirus SARS-CoV-2.
Iniciemos considerando que a largo de
nuestras vidas nos enfrentamos a diversas infecciones causadas por agentes
microbianos patógenos potencialmente mortales. El combate contra estos
microorganismos ha sido contrarrestado por un sistema inmune (SI) o de defensa
muy complejo y eficiente. Este SI se ha dividido tradicionalemnte en inmunidad innata e inmunidad adquirida, aunque recientemente se estudia la inmunidad entrenada, considerada un
proceso biológico dependiente de los estímulos innatos y los eventos de
reprogramación epigenética y metabólica
[13]
.
El
sistema inmune innato, es
por excelencia la forma evolutiva de defensa en el que la supervivencia del
organismo huésped depende de su capacidad para reconocer patógenos y daño
tisular e inducir respuestas de defensa apropiadas
[13,14]
. Es considerada la
primer línea de defensa contra patógenos, se caracteriza por respuestas rápidas
y no específicas, conferidas por células de vida corta como los neutrófilos, eosinófilos, monocitos,
macrófagos y células dendríticas, junto con los basófilos no fagocíticos,
mastocitos y células natural killer
[15]
. Sin embargo, esta línea de defensa no
siempre es suficiente, por lo que el organismo redobla esfuerzos y desencadena
lo que conocemos como Inmunidad
adquirida o adaptativa, este
tipo de memoria inmunológica lo desarrollamos una vez que falló la respuesta
inata frente a un patógeno, es un mecanismo subyacente específico mediante el
cuál el organismo identifica un patógeno, células aberrantes o autoantígenos y
produce una respuesta rápida y muy fuerte para defender al organismo, guarda
memoria del patógeno que le permitirá al organismo identificarlo y combatirlo
si este patógeno vuelve a atacar
[16]
.
De forma general, el sistema inmune
adquirido, tipicamente se constituye de Linfocitos
B y T, sin embargo, en la última década se ha propuesto que las células
asesinas naturales (natural killer), células B y T innatas, las células
linfoides innatas e incluso las células mieloides también presentan diversos
grados de memoria inmune
[16,17]
.
Los linfocitos T representan la primer
línea de combate contra un patógeno específico de la inmunidad adquirida, se
constituyen principalmente por Linfocitos T cooperadores o linfocitos helter (CD4+),
Linfocitos T citotóxicos (CD8+), Linfocitos de memoria y Linfocitos
reguladores. Estos generalmente se encuentran en circulación sanguínea hasta
que son activados mediante células presentadoras de antígeno (dendritas y
macrófagos principalmente, estas células especializadas engloban al virus y
muestran porciones de este para activar las células T causando respuesta a una
respuesta específica contra patógenos o desencadenar una respuesta tumoral. Cuando
se inicia una respuesta de los linfocitos (CD8+) son responsables de
reconocer células infectadas o defectuosas e inducir su apoptosis. Mientras que
los linfocitos CD4+ son responsables de coordinar la acción efectora
de otras células. Los linfocitos helter, cooperadores o CD4+ sirven como
“puente” entre la respuesta innata y adquirida, capaces de activar a los
linfocitos B, una vez que estan activos estos inician los procesos de expansión
clonal específicos de antígeno y su diferenciación
[18]
. Al diferenciarse coordinan respuestas
como la producción de anticuerpos e inmunidad, a través de anticuerpos IgM,
IgG, o linfocitos B de memoria
[2,15]
.
En la segunta parte del esquema propuesto
sobre Infección del SARS-CoV-2 en el huesped (Ewen Callaway y diseñado por Nik
Spencer)
[12]
, podemos observar la respuesta inmune
ante al SARS-CoV-2: una vez que el virus infecta las células huesped y se
replica, este es ingerido por células presentadora de antígeno para impedir que
el virus se disemine a otras células, así como marcar al virus para su
destrucción. Las células T helper coordinan los procesos de identificación de
las células infectadas por el virus y su destrucción de estas células a través
de las células T citotóxicas (CD8+), edemás mediante la coordinación
entre las células B y T se generan anticuerpos, por ejemplo el
anti-coronavirus, generando "memoria" de larga duración que reconocen
el virus y pueden “patrullar” el cuerpo durante meses o años, proporcionando
inmunidad.
CIE/QFB UMSNH
 12.43.35.png)
Figura 4.
Respuesta inmune causada por del SARS-CoV-2 en el huesped.
4. DESARROLLO
DE VACUNAS
Tanto los linfocitos T como los
linfocitos B representan células de memoria, son células que se generan después
de la activación de estos linfocitos por exposición a un antígeno de un
patógeno por ejemplo, estos permanecerán circulando en forma inactivada hasta
que vuelvan a detectar al mismo antígeno, y se caracterizan por presentar una
vida muy prolongada, meses, años o incluso durante toda la vida de un huesped. Este
tipo de células T y B de memoria son la base para el desarrollo de las vacunas,
ya que todas las vacunas funcionan a través de anticuerpos, estos anticuerpos
deben ser preexistentes en el momento en que un patógeno ingresa, así el
huesped cuenta con las herramientas bioquímicas y genera una respuesta
persistente de células plasmáticas para mantener esta capa protectora de
anticuerpos. De acuerdo con Cunningham et al (2008), para obtener vacunas
eficaces es deseable inducir las células B de memoria y aumentar los niveles de
anticuerpos después del reencuentro de antígenos, aunque es posible que una
memoria robusta no sea indispensable para que las vacunas funcionen, ya que se
ha demostrado que el desarrollo de una memoria robusta no es esencial para que
las vacunas sean eficaces
[2,19]
.
Sin embargo, el desarrollo de vacunas
para algunos patógenos invictos como el VIH o nuevos virus como el SARsCoV-2
siguen representando para los vacunólogos un desafío. Actualmente tanto la genética
inversa como la vacunación inversa representan un gran apoyo para los
vacunólogos, lo que les permite tener una mayor identificación de los
componentes del patógeno que puedan tener mayor probabilidad de ser inmunógenos
[20]
, además, el diseño de mejores adyuvantes permitió
el descubrimiento de receptores que reconocen los patrones microbianos y
conducen a la activación de las células dendríticas. Esto genera el ahorro de
dosis y la inducción de una respuesta inmune más rápida, más amplia y más
fuerte
[20,21]
. Una correcta formulación involucra la
selección de la naturaleza de los componentes antigénicos, el tipo de respuesta
inmunitaria deseada, la ruta preferida de administración, evitar
efectos adversos considerables y lograr estabilidad de la vacuna
[20]
. Todo ello debe considerarse antes de
implementarse vacunas y medicamentos contra el COVID-19 sin suficientes
garantías de seguridad.
De acuerdo con Ewen Callaway, “Todas las
vacunas tienen como objetivo exponer el cuerpo a un antígeno que no causará
enfermedad, pero provocará una respuesta inmune que puede bloquear o matar el
virus si una persona se infecta. Se están probando al menos ocho tipos contra
el coronavirus, y se basan en diferentes virus o partes virales”. Aquí se muestra
la guía gráfica donde se explica la naturaleza del diseño de cada vacuna que
están desarrollando al menos 6 grupos de investigación
[12]
:
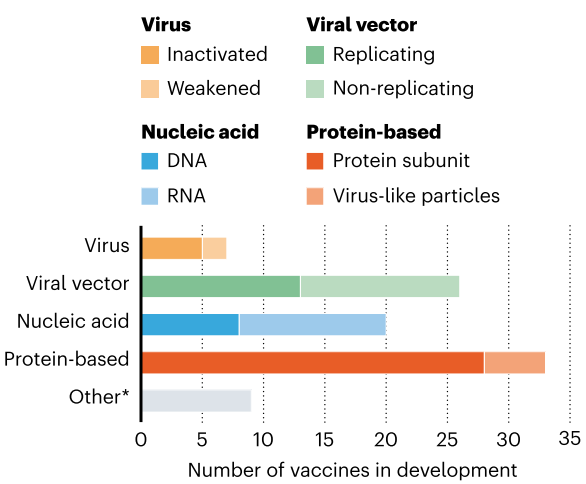
*Otros esfuerzos incluyen probar si las vacunas existentes contra el poliovirus o la tuberculosis podrían ayudar a combatir el SARS-CoV-2 al provocar una respuesta inmune general (en lugar de una inmunidad adaptativa específica), o si ciertas células inmunes podrían modificarse genéticamente para atacar al virus.
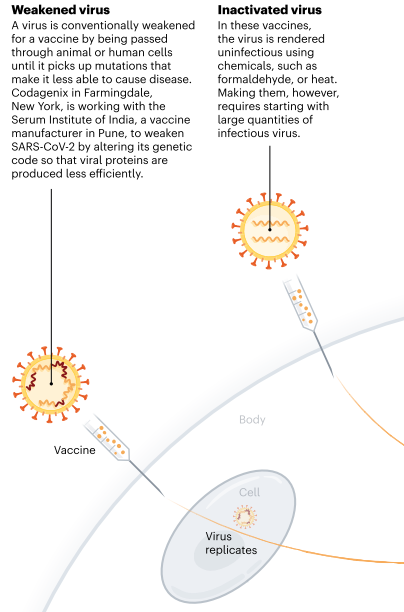
1. VACUNAS
DE VIRUS
Al menos siete equipos están
desarrollando vacunas utilizando el virus mismo, en forma debilitada o
inactivada. Muchas vacunas existentes se fabrican de esta manera, como las
desarrolladas contra el sarampión y la poliomielitis, pero requieren pruebas de seguridad
exhaustivas. Sinovac Biotech en Beijing ha comenzado a probar una versión
inactivada de SARS-CoV-2 en humanos.
Virus debilitado o atenuado. Un virus se debilita convencionalmente para una vacuna al pasar a través de células animales o humanas hasta que se detectan mutaciones en el virus que lo hacen menos capaz de causar enfermedades. Codagenix en Farmingdale, Nueva York, está trabajando con el Serum Institute of India, un fabricante de vacunas en Pune, para debilitar el SARS-CoV-2 al alterar su código genético para que las proteínas virales se produzcan de manera menos eficiente.
Virus inactivado. En estas vacunas, el virus se vuelve no infeccioso usando químicos, como formaldehído o calor. Sin embargo, hacerlos requiere comenzar con grandes cantidades de virus infecciosos.
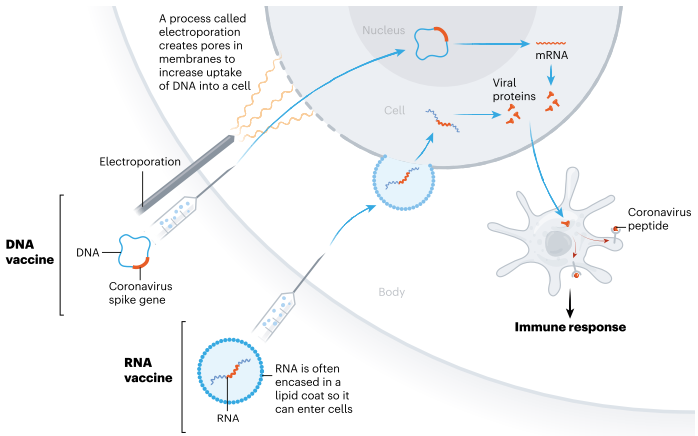
2. VACUNAS DE ÁCIDO NUCLEICO
Al menos 20 equipos pretenden utilizar
instrucciones genéticas (en forma de ADN o ARN) para una proteína de
coronavirus que provoca una respuesta inmune. El ácido nucleico se inserta en
las células humanas, que luego producen copias de la proteína del virus. La
mayoría de estas vacunas codifican la proteína espiga del virus. Las vacunas
basadas en ARN y ADN son seguras y fáciles de desarrollar: producirlas implica
producir solo material genético, no el virus. Pero no están comprobados:
ninguna vacuna autorizada utiliza esta tecnología.
4.1 VACUNAS
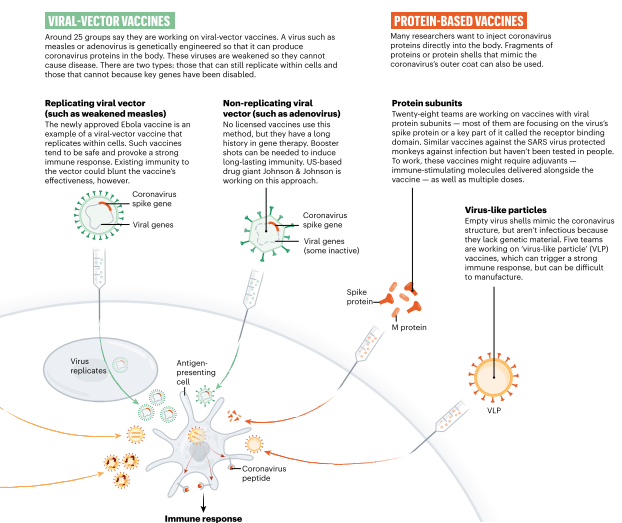
VIRALES-VECTORIALES
Alrededor de 25 grupos dicen que están
trabajando en vacunas de vectores virales. Un virus como el sarampión o el
adenovirus está genéticamente modificado para que pueda producir proteínas de
coronavirus en el cuerpo. Estos virus están debilitados para que no puedan
causar enfermedades. Hay dos tipos: aquellos que aún pueden replicarse dentro
de las células y aquellos que no pueden porque los genes clave han sido
deshabilitados.
Replicación
del vector viral (como
el sarampión debilitado).
La vacuna contra el Ébola recientemente
aprobada es un ejemplo de una vacuna de vector viral que se replica dentro de
las células. Dichas vacunas tienden a ser seguras y provocan una fuerte
respuesta inmune. Sin embargo, la inmunidad existente al vector podría reducir
la efectividad de la vacuna.
Vector
viral no replicante (como el adenovirus).
Ninguna vacuna autorizada utiliza este
método, pero tienen una larga historia en terapia génica. Se pueden necesitar
inyecciones de refuerzo para inducir una inmunidad duradera. El gigante
farmacéutico estadounidense Johnson & Johnson está trabajando en este
enfoque.
4.2 VACUNAS BASADAS EN PROTEÍNA
Muchos investigadores quieren inyectar
proteínas de coronavirus directamente en el cuerpo. También se pueden usar
fragmentos de proteínas o capas proteicas que imitan la capa externa del
coronavirus.
Subunidades
de proteínas.
Veintiocho equipos están trabajando en vacunas con subunidades de proteínas
virales; la mayoría de ellos se están centrando en la proteína espiga del virus
o en una parte clave llamada dominio de unión al receptor. Vacunas similares
contra el virus del SARS protegieron a los monos contra la infección pero no se
han probado en personas. Para funcionar, estas vacunas pueden requerir
adyuvantes (moléculas inmunoestimulantes entregadas junto con la vacuna), así
como dosis múltiples.
4.3 Partículas
similares a virus
Las cáscaras de virus vacías imitan la
estructura del coronavirus, pero no son infecciosas porque carecen de material
genético. Cinco equipos están trabajando en vacunas de "partículas
similares a virus" (VLP), que pueden desencadenar una fuerte respuesta
inmune, pero pueden ser difíciles de fabricar.
Los laboratorios predijeron que una
vacuna comercial podría estar disponible para uso de emergencia o compasivo a
principios de 2021, increíblemente rápido, dado que las vacunas contra los
nuevos patógenos han tardado una década en perfeccionarse y desplegarse.
Bibliografía:
[1] B.D.
Cyranoski, Profile of a future:, Nature. 598 (2020).
[2] A.F.
Cunningham, A. Flores-Langarica, S. Bobat, C.C.D. Medina, C.N.L. Cook, E.A.
Ross, C. Lopez-Macias, I.R. Henderson, B1b cells recognize protective antigens
after natural infection and vaccination, Front. Immunol. 5 (2014) 1–11.
doi:10.3389/fimmu.2014.00535.
[3] M.L.
Agostini, E.L. Andres, A.C. Sims, R.L. Graham, T.P. Sheahan, X. Lu, E.C. Smith,
J.B. Case, J.Y. Feng, R. Jordan, A.S. Ray, T. Cihlar, D. Siegel, R.L. Mackman,
M.O. Clarke, R.S. Baric, M.R. Denison, Coronavirus susceptibility to the
antiviral remdesivir (GS-5734) is mediated by the viral polymerase and the
proofreading exoribonuclease, MBio. 9 (2018) 1–15. doi:10.1128/mBio.00221-18.
[4] A.J.
Brown, J.J. Won, R.L. Graham, K.H. Dinnon, A.C. Sims, J.Y. Feng, T. Cihlar,
M.R. Denison, R.S. Baric, T.P. Sheahan, Broad spectrum antiviral remdesivir
inhibits human endemic and zoonotic deltacoronaviruses with a highly divergent
RNA dependent RNA polymerase, Antiviral Res. 169 (2019).
doi:10.1016/j.antiviral.2019.104541.
[5] F.
Amanat, F. Krammer, SARS-CoV-2 Vaccines: Status Report, Immunity. 52 (2020)
583–589. doi:10.1016/j.immuni.2020.03.007.
[6] C.M.
Chu, V.C.C. Cheng, I.F.N. Hung, M.M.L. Wong, K.H. Chan, K.S. Chan, R.Y.T. Kao,
L.L.M. Poon, C.L.P. Wong, Y. Guan, J.S.M. Peiris, K.Y. Yuen, Role of
lopinavir/ritonavir in the treatment of SARS: Initial virological and clinical
findings, Thorax. 59 (2004) 252–256. doi:10.1136/thorax.2003.012658.
[7] S.
Cobey, Modeling infectious disease dynamics, Science (80-. ). 5659 (2020)
eabb5659. doi:10.1126/science.abb5659.
[8] Y.
Watanabe, J.D. Allen, D. Wrapp, J.S. Mclellan, M. Crispin, Site-specific glycan
analysis of the SARS-CoV-2 spike, Science (80-. ). 9983 (2020) 1–9.
[9] A.C.
Walls, Y.J. Park, M.A. Tortorici, A. Wall, A.T. McGuire, D. Veesler, Structure,
Function, and Antigenicity of the SARS-CoV-2 Spike Glycoprotein, Cell. 181
(2020) 281-292.e6. doi:10.1016/j.cell.2020.02.058.
[10] M.
Letko, A. Marzi, V. Munster, Functional assessment of cell entry and receptor
usage for SARS-CoV-2 and other lineage B betacoronaviruses, Nat. Microbiol. 5
(2020) 562–569. doi:10.1038/s41564-020-0688-y.
[11] J.
Lan, J. Ge, J. Yu, S. Shan, H. Zhou, S. Fan, Q. Zhang, X. Shi, Q. Wang, L.
Zhang, X. Wang, Structure of the SARS-CoV-2 spike receptor-binding domain bound
to the ACE2 receptor, Nature. 581 (2020). doi:10.1038/s41586-020-2180-5.
[12] E.
Callaway, The race for Coronavirus Vaccines, Nature. 580 (2020) 576–577.
https://media.nature.com/original/magazine-assets/d41586-020-01221-y/d41586-020-01221-y.pdf.
[13] M.G.
Netea, J. Domínguez-Andrés, L.B. Barreiro, T. Chavakis, M. Divangahi, E. Fuchs,
L.A.B. Joosten, J.W.M. van der Meer, M.M. Mhlanga, W.J.M. Mulder, N.P. Riksen,
A. Schlitzer, J.L. Schultze, C. Stabell Benn, J.C. Sun, R.J. Xavier, E. Latz,
Defining trained immunity and its role in health and disease, Nat. Rev.
Immunol. (2020). doi:10.1038/s41577-020-0285-6.
[14] R.
Medzhitov, C. Janeway, Innate immune recognition: Mechanisms and pathways,
Immunol. Rev. 173 (2000) 89–97. doi:10.1034/j.1600-065X.2000.917309.x.
[15] P.J.
Delves, Innate and adaptive systems of immunity, Autoimmune Dis. (2019) 45–61.
doi:10.1016/B978-0-12-812102-3.00004-X.
[16] C.M.
Lau, J.C. Sun, The widening spectrum of immunological memory, Curr. Opin.
Immunol. 54 (2018) 42–49. doi:10.1016/j.coi.2018.05.013.
[17] N.M.
Adams, S. Grassmann, J.C. Sun, Clonal expansion of innate and adaptive
lymphocytes, Nat. Rev. Immunol. (n.d.). doi:10.1038/s41577-020-0307-4.
[18] T.P. Paola, Visión panorámica del sistema inmune, Rev. Médica
Clínica Las Condes. 23 (2012) 446–457. doi:10.1016/s0716-8640(12)70335-8.
[19] Á.
González-Fernández, J. Faro, C. Fernández, Immune responses to polysaccharides:
Lessons from humans and mice, Vaccine. 26 (2008) 292–300.
doi:10.1016/j.vaccine.2007.11.042.
[20] A.
Wack, R. Rappuoli, Vaccinology at the beginning of the 21st century, Curr.
Opin. Immunol. 17 (2005) 411–418. doi:10.1016/j.coi.2005.05.005.
[21] P.
Pellegrino, E. Clementi, S. Radice, On vaccine’s adjuvants and autoimmunity:
Current evidence and future perspectives, Autoimmun. Rev. 14 (2015) 880–888.
doi:10.1016/j.autrev.2015.05.014.
En proceso permanente de revisión, programa de documentación científica emergente, actualización cada 24 hrs.
Autores:
Eduardo Ochoa Hernández
Gladys Juárez Cisneros
Nicolás Zamudio Hernández
Lizbeth Guadalupe Villalon Magallan
Rogelio Ochoa Barragán