Texto académico
Autores
Eduardo Ochoa Hernández
Nicolás Zamudio Hernández
Gladys Juárez Cisneros
Filho Enrique Borjas García
Lizbeth Guadalupe Villalon Magallan
Rogelio Ochoa Barragán

4. Tabla periódica de los elementos
Mucho se ha escrito sobre las maravillas de la Tabla periódica y es que resulta complicado excluirle de algún fenómeno o proceso en la concepción del universo. La Tabla Periódica es la piedra de Rosetta de la naturaleza. Para los no iniciados pueden parecer más de 100 cuadros numerados, cada uno conteniendo una o dos letras arregladas en una simetría impar sesgada. Para los químicos, sin embargo, la Tabla Periódica revela los principios de organización de la materia, es decir, los principios de organización de la química. A nivel fundamental toda la química está contenida en la Tabla Periódica, su organización refleja la estructura electrónica de los elementos y, por lo tanto, sus propiedades químicas y comportamiento.
La historia de la Tabla Periódica es la historia de las grandes conquistas del hombre en el microcosmos. Corresponde a un modo de reconocer el mundo, con la integración de los aportes y las continuas modificaciones, ha sido transformada a lo largo del tiempo, recientemente se han añadido nuevos elementos y otros han sido refutados modificándolos o retirándolos, esto por los recientes descubrimientos en física moderna que han refinado aparentes anomalías. De esta manera la Tabla Periódica actúa como un recinto de la historia de la química, una plantilla para los acontecimientos y una base para el futuro de las ciencias químicas… siendo el mapa de los bloques más básicos en la construcción del mundo.
Casi todo el mundo al reconocer un solo elemento químico puede recordar la existencia de la Tabla Periódica, esta refleja el orden natural del universo, agrupaciones de elementos en columnas verticales que comparten algunas propiedades físicas y químicas. Más fundamentalmente la Tabla Periódica ha conducido a un profundo conocimiento de la estructura del átomo y la noción de que los electrones giran esencialmente en torno al núcleo en orbitales específicos. Estos arreglos de electrones permiten racionalizar la tabla Periódica, este conocimiento ha contribuido primeramente al desarrollo de la antigua teoría del quantum, y posterior su ulterior sofisticado la mecánica cuántica, un cuerpo de conocimiento que continúa siendo la teoría fundamental de la física que persigue explicar el comportamiento no solo de la materia sino también la radiación en la luz visible, rayos x y ultravioleta.
Los elementos
Los antiguos filósofos griegos reconocieron solo cuatro elementos, tierra, agua, fuego y aire, algunos de estos filósofos sugirieron que estos elementos consistían en componentes microscópicos, con diferentes formas y que esto explicaba las propiedades de los elementos. Las formas básicas de los cuatro elementos se pensaban como las de los sólidos platónicos, compuestas enteramente de las mismas formas bidimensionales como triángulos y cuadrados. Los griegos por su parte, creían que la tierra consistía en partículas microscópicas cúbicas. Esta asociación surgió porque de todos los sólidos platónicos, el cubo posee las caras con el área superficial más grande[1].
La liquidez del agua fue explicada por apelación a la suave forma poseída por el icosaedro, mientras que el fuego se planteó como doloroso al tacto por su consistencia en partículas afiladas en forma de tetraedros. El aire presumiblemente consistía en octaedros por corresponder al sólido platónico restante. Tiempo después, un quinto solido platónico, el dodecaedro, fue descubierto por matemáticos, y esto llevó a Aristóteles a proponer la existencia de un quinto elemento, o quinta esencia, la aparición del éter[2].

4.1 Los sólidos platónicos, cada uno asociado a los antiguos elementos
La noción de que los elementos se componen de sólidos Platónicos fue refutada, pero correspondió al origen de la noción fecunda de que las propiedades macroscópicas de las sustancias son regidas por las estructuras microscópicas que las componen. Estos elementos persistieron en la Edad Media y más allá aumentando en número por los elementos descubiertos por los alquimistas, predecesores de los químicos modernos. El objetivo más conocido de los alquimistas fue lograr el estado de transmutación de los elementos. En particular, intentaron cambiar el metal base plomo en el oro metal noble, cuyo color, rareza e inercia química le han convertido en una de las sustancias más preciadas desde los albores de la civilización.
Los griegos consideraron a los elementos como principios o tendencias y potencialidades que daban origen a las propiedades observables de los elementos. Esta distinción más sutil entre la forma abstracta de un elemento y su forma observable ha jugado un papel importante en el desarrollo de la química, aunque en estos días la connotación de esta idea no es muy bien comprendida incluso por los químicos profesionales. La noción de un elemento abstracto, sin embargo, ha servido como principio rector fundamental en la concepción de algunos de los pioneros del Sistema periódico como Dimitri Mendeleev, su gran descubridor.
Según lo reportado por la literatura, la química solo comenzó de manera formal cuando mostró la espalda a la alquimia y a la antigua sabiduría griega, y de esta comprensión aparentemente mística de la naturaleza de los elementos. El triunfo de la ciencia moderna se percibe generalmente descansando en la experimentación directa, que sosteniendo que solo lo que puede ser observado debe ser considerado como válido. No en vano, el más sutil y quizá más fundamental sentido del concepto de los elementos generalmente ha sido rechazado. Por ejemplo, Antoine Lavoisier consideró que un elemento debe ser definido por una apelación a la observación empírica, confiriendo así el papel de elementos abstractos o elementos como principios. Lavoisier sostuvo que un elemento debe ser definido como una sustancia material que aún puede dividirse en cualquiera de sus componentes más fundamentales. En 1789 Lavoisier publicó un listado de 33 sustancias simples o elementos, según este criterio empírico. Los elementos antiguos tierra, agua, fuego y aire fueron omitidos acertadamente, pero se conservaba la noción de un elemento abstracto[3].
Muchas de las sustancias que aparecieron en la lista de Lavoisier subsisten como elementos en la valoración de los estándares modernos, mientras que otros como lumiére (luz) y calorique (calor) ya no son considerados como elementos. Rápidos avances en las técnicas de separación y caracterización de las sustancias químicas en los últimos años han permitido a los químicos, ampliar y refinar esta lista. Una importante técnica, la microscopía que mide la emisión y absorción del espectro en diversos tipos de radiación, eventualmente proporcionó un medio preciso por el cual, los elementos pueden ser identificados a través de su “huella digital”. Hoy en día se reconocen unos 90 elementos naturales y unos 25 elementos adicionales han sido sintetizados artificialmente.
4.2 El descubrimiento de los elementos
Algunos elementos como el cobre, hierro y plata se conocen desde los albores de la civilización reconociéndose por sus propiedades físicas de conductividad, maleabilidad y corrosividad. Los elementos pueden aparecer en forma combinada formando moléculas y compuestos o en forma individual, separados de los minerales en los que se encuentran.
Existieron ciertas épocas en la historia de la humanidad que permitieron el progreso en el conocimiento de los elementos, como la Edad de hierro o la Edad de bronce que permitieron fueran añadidos a la Tabla Periódica elementos como el fósforo, mercurio y azufre. En tiempos relativamente modernos, el descubrimiento de la electricidad permitió a los químicos el aislamiento de muchos de los elementos más reactivos que a diferencia de metales como el hierro y cobre no pueden obtenerse por calentamiento de sus minerales con carbón.
Ha habido un número considerable de importantes episodios en la historia de la química al descubrirse media docena de elementos en un periodo de pocos años. El Químico Inglés Humphry Davy empleando la técnica de electroforesis procesó el aislamiento de unos diez elementos incluyendo al calcio, bario, magnesio, sodio y cloro.
Tras el descubrimiento de la reactividad y fisión nuclear más elementos aún fueron descubiertos. Los últimos siete elementos aislados dentro de los límites de los elementos naturales correspondieron al protactinio, hafnio, renio, tecnecio, francio, astato y prometio entre los años de 1917 y 1945. El descubrimiento de nuevos elementos que ocuparían uno a uno los espacios vacíos en el sistema periódico han completado la Tabla periódica, es el caso del elemento 43 conocido como Tecnecio del Griego techne “artificial” fabricado en el curso de reacciones químicas con radio mediante el advenimiento de la física nuclear, sin embargo, recientemente parece que el tecnecio existe naturalmente en la tierra, aunque en cantidades minúsculas[4].
4.3 Nombramiento de los elementos
Parte del nombramiento en la Tabla periódica deriva de la naturaleza individual de los elementos como su coloración o su textura al tacto, mucho de su interés reside en sus nombres. Libros como “The Periodic Table” y Uncle Tungsten por Primo Levi Wrote y Oliver Sacks han sido escritos introduciendo los elementos como reconocibles por la humanidad[5].
Durante muchos siglos en los que los elementos se descubrieron han pasado por muchos criterios y enfoques diferentes para otorgarles un nombre. El prometio elemento 61, toma su nombre de Prometeo, el Dios que robó el fuego del cielo otorgándoselo a los seres humanos solo para después ser castigados por Zeus. El prometio corresponde a uno de los pocos elementos que no se producen naturalmente en la tierra. Obteniéndose como un producto del decaimiento de la fisión de otro elemento, el uranio.
Planetas y otros cuerpos celestes han sido empleados también para el nombramiento de algunos elementos. Helio es el nombre de helios, el nombre griego para el sol. Primero fue observado en el espectro del sol en 1868 y no fue hasta 1895 que fue identificado por primera vez en muestras terrestres. Del mismo modo ocurrió el nombramiento del palladium posterior a la aparición del asteroide Pallas cuyo nombre a la vez se confirió por Pallas la Diosa griega de la sabiduría. Otro de ellos el elemento cerio nombrado por Ceres, el primer asteroide descubierto en el año de 1801.
Muchos elementos obtuvieron sus nombres de los colores. El cloro gas amarillo verde proviene de la palabra griega khloros que denota esta coloración. El Cesio es nombrado del Latín cesium que significa de coloración gris azulado, lo que es justificado por la aparición de líneas prominentes de color gris azulado en su espectro. Las sales del elemento rodio son de coloración rosada, lo que explica que su nombre fuese tomado del término rhodon, que significa rosa en griego. El metal talio, recibe su nombre del Latín thallus, que significa ramita verde, este elemento descubierto por William Crookes posee una prominente línea verde en su espectro[6].
Un gran número de nombres de los elementos proceden del lugar donde vivió su descubridor o un lugar al que este deseaba honrar como el hafnio de hafnia nombre latino de Copenhague, lutecio de lutetia, del Latín París, entre otros como americio, berkelio, californio, darmstadio, europio, francio, germanio, hassio, polonio galio y renio. Sin embargo otros nombres de los elementos derivan de lugares geográficos relacionados con los minerales donde fueron encontrados. Esta categoría incluye el caso de cuatro elementos nombrados por la aldea cerca de Ytterby encontrada cerca de Estocolmo, erbio, terbio, a yterbio e itrio encontrados en los minerales de sus alrededores, mientras que un quinto elemento, el holmio fue nombrado del Latín Estocolmo.
Elementos más recientemente sintetizados reciben su nombre de su descubridor o de una persona a la que los descubridores deseaban honrar, en estos se incluyen bohrio, curio, einstenio, fermio, laurencio, meitnerio, nobelio, roentgenium, rutherfordio y seaborgio.
El nombramiento de los elementos transuránicos más tarde ha presentado controversias nacionalistas y amargas disputas sobre quien sintetizó por primera ocasión el elemento y que por tanto confirió el honor de otorgarle un nombre. En un intento de resolver estas disputas, la International Union of Pure and Applied Chemistry (IUPAC) decretó que los elementos deben ser nombrados imparcial y sistemáticamente con los numerales del Latín para el número atómico del elemento en cada caso. El elemento 105 por ejemplo sería conocido como un-nil-pentium, mientras que el elemento 106 correspondería a un-nil-hexium. Más recientemente posterior a la deliberación de los casos de algunos de los elementos superpesados, la IUPAC ha acordado devolver el derecho de nombramiento a los descubridores o sintetizadores determinados como legítimos en cada caso. Los elementos 105 y 106 son llamados ahora dubnio y seaborgio respectivamente[7].
Los símbolos que se emplean para representar cada elemento en la Tabla periódica también tienen una historia digna de nuestro interés. En los tiempos de la alquimia, los símbolos de los elementos a menudo, coincidieron con los de los planetas desde que fueron nombrados o asociados a estos. El elemento mercurio, compartió el mismo símbolo que el del Mercurio planeta más interno del sistema solar, el cobre fue asociado con el planeta Venus, juntos elemento y planeta compartieron el mismo símbolo.
4.4 Nombres y símbolos de los elementos antiguos
Cuando John Dalton publicó su teoría atómica en 1805, conservó varios símbolos alquímicos de los elementos. Estos eran algo confusos y complicados en su interpretación lo que dificultaba significativamente fueran plasmados en la reproducción de libros y artículos. El uso moderno de los símbolos que representan a los elementos fue introducido por el químico Jöns Jacob Berzelius en 1813[8].
Una pequeña minoría de los elementos en la Tabla periódica moderna son representados por una sola letra del alfabeto. En estos se incluyen el hidrógeno, carbono, oxígeno, azufre y flúor que aparecen como H, C, O, N, S y F. La mayoría de los elementos son representados por dos letras, la primera corresponde a una letra mayúscula y la segunda a una letra minúscula. Por ejemplo Kr, Mg, Ne, Ba, Sc siendo criptón, magnesio, neón, bario y escandio respectivamente. Algunos de los símbolos no son intuitivamente obvios tales como Cu, Na, Fe, Pb, Hg, Ag, Au, etc., sus nombres son derivados del latín denominándose a estos elementos como cobre, sodio, hierro, plomo, mercurio, plata y oro. El tungsteno es representado por una letra W tomada del nombre Aleman del elemento, Wolfram.
4.5 La Tabla periódica moderna
La manera en que los elementos se organizan en filas y columnas en la Tabla periódica revela muchas de las propiedades relacionadas entre ellos. Algunas de estas relaciones son muy bien conocidas mientras que otras aún esperan por ser descubiertas. En la década de 1980, los científicos descubrieron la superconductividad, siendo el flujo de una corriente eléctrica con una resistencia cero, produciéndose a temperaturas mucho mayores de las que anteriormente habían sido observadas. De los valores típicos de 20 K o menos, la temperatura de superconducción saltó rápidamente a valores de hasta 100 K. El descubrimiento de los superconductores de alta temperatura se produjo cuando los elementos lantano, cobre, oxígeno y bario se combinaron juntos para la formación de un compuesto complejo que permitió demostrar la superconductividad de alta temperatura.
Al profundo esfuerzo por evaluar la temperatura a la que podría mantenerse el efecto de superconductividad siguió una ráfaga de actividades en todo el mundo. El objetivo primordial era lograr la superconductividad a temperatura ambiente, lo que permitiría magníficos avances tecnológicos. Uno de los principales principios rectores empleados en esta búsqueda correspondió a la Tabla periódica de los elementos. La Tabla permitía a los investigadores reemplazar algunos de los elementos en el compuesto con otros elementos de comportamiento similar, para luego examinar el resultado en su comportamiento como superconductores. De esta manera, el elemento itrio fue incorporado a un nuevo conjunto de superconductores para producir una temperatura de superconducción de 93 K en el compuesto YBa2Cu3O. Este conocimiento y sin duda muchos más, se encuentran latentes en el Sistema periódico, algunos en espera de ser descubiertos y brindar su mejor utilidad.
Más recientemente, incluso se han descubierto una nueva clase de superconductores de alta temperatura. Oxypnictides (Oxínitrogenados) una clase de materiales que incluyen al oxígeno, uno de los nitrogenoides (grupo 15 de los elementos), y uno o más elementos externos a este grupo. El interés en estos compuestos ha aumentado dramáticamente posterior a la publicación de las propiedades de los superconductores LaOFeP y LaOFeAs, los cuales fueron descubiertos en 2006 y 2008 respectivamente. Una vez más, la idea de utilizar el arsénico (As) en este último compuesto proviene de su posicionamiento, que está directamente debajo del fósforo en la Tabla periódica[9].
Analogías químicas entre los elementos de un mismo grupo son también de gran interés en el campo de la medicina. Por ejemplo, el berilio elemento que se encuentra en la cima del grupo 2 de la Tabla periódica y sobre el magnesio, debido a la similitud entre estos dos elementos, el berilio puede sustituir al magnesio, un elemento esencial para los seres humanos. Este comportamiento representa una de las muchas maneras en las que el berilio es tóxico para los humanos. Del mismo modo, el cadmio, elemento que se encuentra directamente debajo del zinc en la Tabla periódica, posee un efecto cuyo resultado se traduce en la sustitución posible del cadmio por el zinc en muchas de las enzimas vitales.
Las similitudes también pueden presentarse entre los elementos en posiciones adyacentes en los periodos de la Tabla periódica. Por ejemplo, el platino se encuentra junto al oro. Durante mucho tiempo se ha sabido que un compuesto inorgánico de platino llamado cis-platino puede curar varias de las formas del cáncer. Como resultado, se han desarrollado muchos fármacos en los que átomos de oro han sido desarrollados para tomar el lugar del platino, y esto ha producido algunos nuevos fármacos exitosos.
Un último ejemplo de las consecuencias médicas de cómo son colocados los elementos en la Tabla periódica proviene del rubidio ubicado directamente debajo del potasio en el grupo 1 de los elementos. En un proceso parecido a los anteriores, los átomos de rubidio pueden mimetizar átomos de potasio y de la misma manera que los átomos de potasio pueden ser fácilmente absorbidos en el cuerpo humano. Este comportamiento es aprovechado en el monitoreo de técnicas, ya que el rubidio es atraído por células cancerígenas, especialmente en los casos de afectación del cerebro.
La Tabla periódica convencional consiste en periodos (filas) y grupos (columnas). En ellos son observables las tendencias entre los elementos que van a través y hacia debajo de estos. Al atravesar un periodo se pasa de los metales como el potasio y calcio ubicados hacia la izquierda, a través de los metales de transición como el hierro, cobalto y níquel, posterior a través de algunos elementos semimetálicos como el germanio y algunos no metales como el arsénico, selenio y bromo, ubicados en el extremo derecho de la tabla. En general, hay una gradación suave en las propiedades químicas y físicas en cómo se intercepta un periodo, pero excepciones a esta regla general abundan y hacen del estudio de la química un fascinante e impredecible campo complejo.
Los metales pueden variar de suaves opacos sólidos como sodio o potasio a sustancias fuertes brillantes como el cromo, platino, o el hierro. No metales por el contrario tienden a ser sólidos o gases, como el oxígeno o el carbono respectivamente. En cuanto a su aspecto, en ocasiones es difícil distinguir entre metales sólidos y no metales sólidos. A un novel, un fuerte y brillante no metal puede parecerle más metálico que un metal blando como el sodio. La tendencia periódica de los metales se repite con cada periodo, de manera que cuando los periodos se apilan forman grupos de elementos similares. Elementos dentro de un mismo grupo tienden a compartir diversas propiedades físicas y químicas importantes, aunque se presentan excepciones.
Recientemente la IUPAC ha recomendado la enumeración de los grupos secuencialmente con un número arábigo de izquierda a derecha, como grupos del 1 al 18, omitiendo el uso de las letras A y B que pueden apreciarse en anteriores versiones de la Tabla periódica[10].
4.6 Formas de la Tabla Periódica
Han sido vastas las representaciones, estimándose más de 1,000 Tablas periódicas publicadas en forma impresa, o más recientemente en internet. ¿Cómo se relacionan todas ellas? ¿existe una Tabla periódica ideal? Estas son preguntas que se explorarán en las siguientes líneas, en ellas se muestran algunos de los aspectos más interesantes de la ciencia moderna[11].
Una de las maneras de clasificar las Tablas periódicas que han sido publicadas es considerando tres formatos básicos. En primer lugar, se encuentran las Tablas de formato corto originalmente estructuradas y publicadas por los pioneros de la Tabla periódica como Newlands, Lothar Meyer y Mendeleev.
En estas tablas se encontraban esencialmente hacinados todos los entonces elementos conocidos constaban de 8 grupos (columnas verticales) que reflejan el hecho de que, en términos generales, los elementos parecen repetirse en un intervalo de 8 elementos, si estos se encuentran en una secuencia natural. Al recabarse más información sobre las propiedades de los elementos y descubrir nuevos elementos, apareció un nuevo tipo de arreglo llamado la Tabla de formato medio largo, este comenzó a ganar prominencia y popularidad en la sociedad académica.
Hoy en día la forma de la Tabla periódica es casi totalmente ubicua, una característica un tanto extraña es que el cuerpo principal de la Tabla no integra todos los elementos, apreciando un vacío inaparente que corresponde a la ausencia entre los elementos 56-71 y luego nuevamente entre los elementos 88 y 103. Los elementos “desaparecidos” se agrupan en lo que parece una nota desplegada de la Tabla principal.
Este acto de separación de los elementos de las tierras raras como tradicionalmente han sido llamados, se realizó meramente por conveniencia. De no llevarse a cabo, la Tabla periódica aparecería mucho más ampliada, 32 grupos de sus elementos para ser precisos, en lugar de los 18 presentados a lo ancho de esta. El formato de 32 elementos de ancho no es flexible para ser reproducido en el interior de la cubierta de los libros de texto de química o en los grandes afiches presentados en escuelas y laboratorios. Pero si los elementos aparecieran en esta forma, como algunas ocasiones son mostrados, es apreciable una Tabla periódica de formato ampliado que podría presumirse resultaría más correcta que el usual formato medio largo adoptado por concesión, en el sentido estricto de que la secuencia de elementos se encuentra intacta.
Pero ¿Cuáles son los ocupantes de la Tabla periódica? Esta cuestión nos permite volver a la tabla periódica general y la elección del formato medio largo popularizado para la caracterización de los elementos en un sistema de dos dimensiones. ¿Cómo se descubrieron los elementos? ¿cuáles y cómo son los elementos? ¿Cómo se diferencian a medida que avanzamos hacia abajo de un grupo de la Tabla periódica o nos desplazamos en forma horizontal a lo largo de un periodo?
4.7 Grupos típicos de elementos en la Tabla Periódica
En el extremo izquierdo de la Tabla periódica, el grupo 1 contiene los elementos metálicos como el sodio, potasio y rubidio. Estos corresponden a sustancias inusualmente suaves y reactivas, muy diferentes a lo que normalmente se consideran metales como el hierro, cromo, oro, o plata. Los metales del grupo 1 son tan reactivos que simplemente al colocar un pequeño trozo de uno de ellos en interacción con el agua pura, se produce una reacción vigorosa que como productos desprende hidrógeno en forma de gas y se mantiene una solución alcalina incolora. Los elementos del grupo 2 incluyen al magnesio, calcio y bario, y tienden a ser menos reactivos que los del grupo 1 en la mayoría de los aspectos.
Moviéndose hacia la derecha se encuentra un bloque rectangular central de elementos conocidos colectivamente como metales de transición, en ejemplos de ellos se incluyen elementos como el hierro, cobre y zinc. En las primeras Tablas periódicas, conocidas como Tablas de formato corto, estos elementos se colocaron entre los que ahora son llamados elementos del grupo principal.
Varias características químicas valiosas de estos elementos se pierden en la moderna Tabla periódica debido a la forma en que se han separado del cuerpo principal de la Tabla, aunque las ventajas de este acomodo posterior son significativamente mayores que las posibles pérdidas. Posicionado a la derecha de los elementos de transición en la Tabla periódica de formato medio largo, se encuentra otro bloque de elementos representativos partiendo del grupo 13 y terminando con el grupo 18, los gases nobles en el extremo derecho de la tabla.
En ocasiones las propiedades de un grupo no son inmediatamente obvias. Este es el caso del grupo 14, que consiste en el carbono, silicio, germanio, estaño y plomo. Es apreciable una gran diversidad en las propiedades de los elementos al progresar por el grupo. El carbono a la cabeza del grupo corresponde a un no metal sólido que puede presentarse en tres formas moleculares completamente diferentes el diamante, grafito y fullerenos, y que constituye el soporte de todos los sistemas vivos. Todo ello aunado a la capacidad estructural del carbono para asociarse a otros elementos por enlaces sencillos, dobles y triples, de manera fundamental en unión al hidrógeno conforma a los hidrocarburos y estos a su vez forman el cuerpo carbonado de las biomoléculas de ácidos nucleicos, proteínas, carbohidratos y lípidos.
El siguiente elemento, silicio corresponde a un semimetal que curiosamente corresponde al soporte de la vida artificial o por lo menos inteligencia artificial al ocupar el corazón de los equipos computacionales. Prosiguiendo hacia abajo nos encontramos con el germanio, semimetal recientemente descubierto propuesto por Mendeleev determinando en su caracterización algunas de las propiedades qué él mismo anticipó. Moviéndose hacia el estaño y la plata, se llega a dos metales conocidos desde la antigüedad. A pesar de la amplia diversificación entre ellos en términos de su comportamiento metal-no metal, los elementos del grupo 14 sin embargo, son similares en un sentido químico importante todos ellos muestran un máximo de combinación energética o valencia de cuatro[12].
La aparente diversidad de los elementos del grupo 17 es aún más pronunciada, los elementos flúor y cloro que encabezan el grupo corresponden a gases tóxicos. El próximo miembro, el bromo es uno de los únicos dos elementos conocidos que existen como líquidos a temperatura ambiente, siendo el otro el metal mercurio. Moviéndose más alejados hacia abajo, encontramos un elemento sólido, el yodo de coloración violeta-negro. Si a un químico novel se le pidiera agrupar estos elementos por su apariencia, resultaría poco probable qué considerara la clasificación conjunta del flúor, cloro, bromo y yodo. Esta es una instancia donde la sutil distinción entre lo observable y el sentido abstracto del concepto de elementos puede ser especialmente útil. La similitud entre ellos reside principalmente en la naturaleza abstracta de los elementos y no en los elementos como sustancias que pueden ser aisladas y observables.
Moviéndose hacia la derecha encontramos un grupo notable de elementos, los gases nobles, todos ellos aislados justo antes o en inicios del siglo XX. Su propiedad principal, algo paradójicamente, al menos en su concepción de aislamiento fue que carecían de propiedades químicas evidentes. Estos elementos que agrupan al helio, neón, argón y criptón no fueron incluidos en las primeras Tablas periódicas, puesto que eran desconocidos y completamente inesperados. En su descubrimiento plantearon un reto formidable en el Sistema periódico, que finalmente fue resuelto con éxito por el acomodo de un nuevo grupo extendiéndose a lo largo de la Tabla periódica, la aparición del grupo 18 de los gases nobles.
Otro bloque de elementos, encontrado al pie de la Tabla periódica moderna, se compone de los elementos de las tierras raras que comúnmente son descritos, como elementos literalmente desconectados. Pero esto corresponde solo a una característica evidente usada en la exhibición del sistema periódico. Así como los metales de transición generalmente son insertados como un bloque dentro del cuerpo principal de la tabla, es posible hacer lo mismo con los elementos de las tierras raras. De hecho han sido publicadas algunas versiones de la Tabla periódica con esta integración. Mientras que las Tablas de formato ampliado confieren a las tierras raras un lugar más adecuado en el acomodo secuencial natural de los elementos, no son convenientes en el acomodo de “láminas” del sistema periódico. Aunque hay un número de diferentes formas de la Tabla periódica, lo que subyace en su construcción y acomodo, sin importar la forma de representarlo, es la Ley periódica[13].
4.8 Ley periódica
La ley periódica establece que después de ciertos regulares pero diferentes intervalos, los elementos químicos muestran una repetición aproximada de sus propiedades. Por ejemplo, flúor, cloro y bromo integrados en el grupo 17, comparten la propiedad de formar sales cristalinas blancas en interacción con el sodio metálico con la formula NaX (donde X corresponde a cualquier elemento del grupo de los halógenos). Esta repetición periódica de propiedades es el hecho fundamental que subyace en todos los aspectos del Sistema periódico.
La ley periódica plantea algunas cuestiones filosóficas interesantes. En primer lugar, la periodicidad entre los elementos no es constante ni exacta. El formato medio largo generalmente usado en la Tabla periódica, en el primer periodo se integran dos elementos, mientras que el segundo y el tercero contienen ocho, el cuarto y quinto contienen 18 y así sucesivamente. Esto implica una periodicidad variable que consiste en 2, 8, 8, 18, etc., una periodicidad significativamente distinta a la encontrada en las notas de una escala musical.
Entre los elementos, sin embargo, no solo a lo largo de un periodo varían las propiedades físicas y químicas, sino que la periodicidad no es exacta. Los elementos en cualquier grupo de la Tabla periódica no son repeticiones exactas en cada uno. En este sentido su periodicidad no es precisa a diferencia de la escala musical, en la que uno vuelve a una nota por la misma letra, que suena como la nota original pero definitivamente no es idéntico a la que es una octava más alta.
La diferente longitud de los periodos de los elementos y la naturaleza aproximada de la repetición han inspirado en algunos químicos el abandonar el término “ley” en relación con la periodicidad química. La periodicidad química puede no parecer una ley, como lo son la mayoría de las leyes en la física. Sin embargo, puede argumentarse que la periodicidad química ofrece un ejemplo de una ley química general, aproximada y compleja, fundamentalmente se muestra una ley como el comportamiento de los elementos.
Tal vez es momento de introducir otros aspectos de la terminología. ¿Cómo se diferencia un sistema periódico de una Tabla periódica? El término Sistema periódico es el más general de los dos. El Sistema periódico es la noción más abstracta que sostiene que existe una relación fundamental entre los elementos químicos. Una vez que se convierte en un intento de mostrar el sistema periódico, se puede elegir un arreglo tridimensional, una forma circular o cualquier número de Tablas de dos dimensiones diferentes. Por supuesto, el término Tabla implica estrictamente una representación bidimensional. Así que aunque el término Tabla periódica es abismalmente el más conocido de los tres términos, Ley, Sistema y Tabla, corresponden realmente a un acomodo secuencial restringido[14].
4.9 Reacciones de los elementos y ordenamiento de los elementos
Mucho de lo que se sabe acerca de los elementos ha sido aprendido de la manera en que estos interaccionan con otros elementos, y de la asociación de sus propiedades. Los metales del sitio izquierdo de la Tabla periódica convencional corresponden a los opuestos complementarios de los no metales que suelen posicionarse en el sitio derecho. Esto es así porque, en términos modernos, los metales forman iones positivos (cationes) por la pérdida de electrones, mientras que los no metales ganan electrones para formar iones negativos (aniones). Dichos iones opuestamente cargados se combinan formando un estado neutro de carga que corresponde a sales como el cloruro de sodio o el bromuro de calcio. Existen otros aspectos complementarios de los elementos metales y no metales. Elementos metálicos óxidos o hidróxidos se disuelven en agua formando ácidos, mientras que los no metales óxidos o hidróxidos se disuelven en agua formando bases. Un ácido y una base interaccionan juntos en una reacción de neutralización para formar una sal con la liberación de una molécula de agua.
Ácidos y bases están relacionados en los orígenes del Sistema periódico puesto que el peso equivalente representó uno de los primeros principios rectores para el ordenamiento de los elementos. El peso equivalente de cualquier metal particular originalmente se obtuvo de la cantidad del metal que reaccionaba con una cantidad de un ácido estándar preestablecido. Posteriormente se generalizó el término peso equivalente para denotar la cantidad del elemento que reaccionaba con una cantidad estándar de oxígeno. Históricamente, el ordenamiento de los elementos a través de los periodos se determinó por el peso equivalente, posterior por el peso atómico y eventualmente por el número atómico.
Químicos comenzaron a hacer comparaciones cuantitativas entre las cantidades de ácido y base que reaccionaban juntos. Este procedimiento luego fue extendido a la interacción entre ácidos y metales. Esto permitió a los químicos el ordenamiento de los metales en una escala acorde su peso equivalente, la cantidad del metal que interaccionaba con una cantidad fija de un ácido estándar.
El peso atómico, a diferencia del peso equivalente, fue obtenido a principios de 1800 por John Dalton, quien indirectamente deducía las medidas sobre las masas de los elementos que se combinaban juntos. Pero hubo complicaciones en este método aparentemente simple que obligaron a Dalton a desarrollar suposiciones acerca de las fórmulas químicas de los compuestos en cuestión. La clave de este cuestionamiento correspondía a la valencia, al poder de combinación de un elemento. Por ejemplo un átomo univalente se combina con átomos de hidrógeno en una proporción 1:1. Átomos divalentes, como el oxígeno, se combinan en una proporción 2:1 y así sucesivamente.
El peso equivalente es considerado en ocasiones como un concepto meramente empírico ya que no parece depender de la creencia en la existencia de los átomos. Tras la introducción de los pesos atómicos, muchos químicos se sentían inquietos sobre la noción del átomo y trataron de revertirse al concepto más aceptado de pesos equivalentes. Ellos consideraron que al suponer una determinación meramente empírica sería por tanto más confiable.
Durante muchos años, persistió una gran confusión creada por el uso indistinto del peso atómico y el peso equivalente. Dalton mismo asumió que el agua consistía en un átomo de hidrógeno combinado con un átomo de oxígeno, lo cual permitiría que su peso atómico y peso equivalente correspondieran a uno mismo, pero su propia conjetura acerca de la valencia aplicada al átomo de oxígeno bastó para refutarlo. La verdadera diferenciación entre peso atómico, peso equivalente y valencia fue concebida en 1860 en la primera conferencia científica celebrada en Karlsruhe, Alemania. La aclaración y adopción general de pesos atómicos consistentes, despejó el camino para el descubrimiento independiente del Sistema periódico por seis personas de manera individual en varios países, que propusieron algunas formas de la Tabla periódica que resultaron exitosas en diferentes grados, colocando a los elementos en orden creciente respecto a su peso atómico.
El tercer principio impuesto en la arquitectura de la Tabla periódica, el orden de los conceptos mencionados con anterioridad corresponde al número atómico de los elementos. Una vez que se entendió que el número atómico había desplazado al peso atómico como principio rector en la ordenación de los elementos ya no se dependía de la combinación de pesos, el número atómico puede permitir una interpretación microscópica simple en cuanto a la estructura de los átomos de cualquier elemento. El número atómico de un elemento es determinado por el número de protones o unidades de carga positiva, en el núcleo de sus átomos. El número de protones a su vez corresponde con el número de neutrones o unidades neutras distribuidas en el núcleo junto con los protones, y el número de electrones o unidades negativas que rodean al núcleo distribuidos en los orbitales atómicos. Así cada elemento de la Tabla periódica contiene un protón más que el elemento anterior y por tanto un neutrón y electrón adicional, lo que se traduce en el ascendimiento del peso atómico en este mismo orden, y es el número atómico el que permite la identificación de cualquier elemento particular. En otras palabras, los átomos de cualquier elemento particular siempre contienen el mismo número de protones, pero algunos pueden diferir en el número de neutrones que contienen dando lugar al fenómeno de isotopía, estos elementos presentan isotopos[15].
4.10 Diferentes representaciones del sistema periódico
El Sistema periódico moderno consigue ordenar eficientemente los elementos por su número atómico de tal manera que se acomodan en grupos naturales, pero este Sistema puede ser representado por más de una forma. Existen muchas formas de la Tabla periódica, algunos diseños resultan más apropiados para algunos usos. Mientras que un químico puede preferir una forma que resalta la reactividad de los elementos, tal vez un ingeniero eléctrico pueda preferir un modelo que permita centrarse en las similitudes y patrones de conductividad eléctrica.
La forma en que se muestra el Sistema periódico es un tema fascinante y que apela sobre todo a la imaginación popular. Desde la época de las primeras Tablas periódicas de Newlands, Lothar, Meyer, y Mendeleev, ha habido muchos esfuerzos para obtener una Tabla periódica “ultimate”. De hecho se ha estimado que dentro de los cien años de la introducción del cuadro famoso de Mendeleev en 1869, han sido publicadas aproximadamente 700 versiones diferentes versiones de la Tabla periódica. Los diseños incluían todo tipo de alternativas, tales como Tablas tridimensionales, hélices, círculos concéntricos, espirales, zigzags, Tablas de imagen de espejo y así sucesivamente. Incluso hoy en día, los artículos regularmente publicados tienen por objeto mostrar nuevas y mejoradas versiones del sistema periódico.
Fundamentalmente en todos los esfuerzos por mejorar la Ley periódica se conserva una misma forma. La representación es una cuestión de convención que pareciera entrar en conflicto con la noción del realismo que puede ser relativa a los puntos de repetición de las propiedades periódicas presentadas en cualquier Tabla periódica.
4.11 Cambios recientes en la Tabla Periódica
En 1945, Glean Seaborg propuso que los elementos englobados desde el actinio, numero 89 deben ser considerados como una serie de tierras raras, mientras que con anterioridad había supuesto que la serie de tierras raras comenzaría en uranio, número 92. La nueva Tabla periódica presentada por Seaborg reveló una analogía entre el europio (63) y gadolinio (64) y los elementos aún no descubiertos 95 y 96 respectivamente. Tomando como base estas analogías, Seaborg logró sintetizar e identificar los dos nuevos elementos, que posteriormente fueron llamados americio y curio. Posteriormente fue sintetizada una serie de elementos transuránicos.
La forma estándar de la Tabla periódica también ha sufrido algunas modificaciones menores con respecto a los elementos que encabezan el inicio de la tercer y cuarta fila de los elementos de transición. Mientras que antiguas Tablas periódicas muestran los elementos lantano (57) y actinio (89), la evidencia experimental y análisis más recientes han colocado al lutecio (71) y Laurencio (103) en las disposiciones anteriores. Resulta impresionante corroborar que algunas Tablas periódicas aún más antiguas basadas en las propiedades macroscópicas habían previsto estas transformaciones.
Estos son algunos ejemplos de ambigüedades en lo que puede denominarse clasificación secundaria, que no es tan inequívoca como la clasificación primaria o la ordenación secuencial de los elementos. En términos químicos clásicos, la clasificación secundaria corresponde a las similitudes químicas entre los distintos elementos de un mismo grupo. En términos modernos, la clasificación secundaria es explicada mediante el concepto de configuraciones electrónicas. Independientemente de si se toma un enfoque químico clásico o un enfoque físico moderno basado en las configuraciones electrónicas, la clasificación secundaria de este tipo representa un aborde más tenue e inespecífico respecto de la clasificación primaria y no puede establecerse categóricamente. La manera en que se definió la clasificación secundaria establece un ejemplo moderno de la tensión entre la categorización de las propiedades químicas y propiedades físicas para la clasificación de los elementos.
La colocación precisa de un elemento dentro de los grupos de la Tabla periódica puede variar dependiendo de si uno pone más énfasis en la configuración electrónica (una propiedad física) o en sus propiedades químicas. De hecho muchos de los debates recientes sobre la disposición del helio en el Sistema periódico giran en torno a la importancia relativa que debe asignarse a estos dos enfoques.
4.12 Tablas Periódicas antes y después de la modificación de Seaborg
En los últimos años ha aumentado el número de elementos sobrepasando los 100 como el resultado de la síntesis de elementos artificiales. En el momento de la escritura de estas lineas, la evidencia ha sido reportada para los elementos número 117 y 118. Dichos elementos suelen ser muy inestables y sólo unos pocos átomos son producidos en un momento indeterminado. Sin embargo, la concepción de novedosas técnicas químicas ha permitido la examinación de las propiedades químicas de estos elementos considerados superpesados y corroborar si las extrapolaciones de las propiedades químicas periódicas se mantienen para átomos de enormes proporciones. En una nota más filosófica, la producción de estos elementos nos permite examinar si la ley periódica es una ley integra excepcional, de la misma clase que la Ley de la gravitación de Newton, o si las desviaciones de las repeticiones esperadas de las propiedades químicas pueden llevarse a cabo una vez alcanzado un suficientemente alto número atómico. En lo encontrado hasta el momento no existen sorpresas, pero la cuestión de si algunos elementos superpesados conservan las propiedades químicas periódicas dista mucho de ser completamente resuelto. Una complicación importante presentada en esta región de la Tabla periódica es la importancia creciente de efectos relativistas. Estos efectos provocan la adopción de configuraciones electrónicas inesperadas en algunos átomos que podrían resultar en propiedades químicas igualmente inesperadas.
4.13 Comprensión del sistema periódico
Desarrollos en la física han tenido una profunda influencia sobre la manera en que actualmente es comprendido el Sistema periódico. Las dos teorías más importantes en la física moderna corresponden a la teoría de Einstein de la relatividad y la teoría de la mecánica cuántica.
La primera de ellas ha tenido un impacto limitado en la comprensión del Sistema periódico, pero se ha ido transformando en una herramienta imprescindible en los cálculos exactos sobre átomos y moléculas. La necesidad de considerar a la relatividad se presenta cuando los objetos en cuestión se mueven a velocidades cercanas a la de la luz. Los electrones internos, especialmente los de los átomos más pesados en el sistema periódico, fácilmente pueden alcanzar dichas velocidades relativistas. Resultaría imposible desarrollar un cálculo exacto, especialmente en átomos pesados, sin las correcciones relativistas. Además muchas de las propiedades aparentemente mundanas de los elementos, como el característico color del oro o la liquidez del mercurio, pueden explicarse mejor valiéndose de los efectos relativistas debido al rápido movimiento interior de los electrones en los orbitales atómicos.
Pero es la segunda teoría de física moderna la que ha ejercido en gran medida el papel más importante en los intentos por comprender mediante un aborde teórico el Sistema periódico. La teoría cuántica en realidad nació en el año 1900. Primero fue aplicada a los átomos por Niels Bohr, que persiguió la idea de que las similitudes entre los elementos de cualquier grupo de la Tabla periódica podían ser explicadas por contener el mismo número de electrones en el último nivel de energía. La noción de un particular número de electrones en el orbital electrónico más externo esencialmente corresponde al Quantum como concepto. Se supone que los electrones poseen solo algunos quantums o paquetes de energía, y dependiendo del número de quantums que poseen se mantienen en una u otra posición del orbital alrededor del núcleo del átomo[16].
Poco después, Bohr había introducido el quantum para el átomo e impulsados por su relativo éxito (relativa aceptación) muchos otros desarrollaron así sus teorías hasta que la antigua teoría cuántica dio origen a la mecánica cuántica. Bajo la nueva descripción, los electrones son considerados al igual que las ondas como partículas. Incluso se presentó la entonces novedosa noción de que los electrones no siguen trayectorias definidas u orbitales alrededor del núcleo. En cambio la descripción cambió al abordar las nubes electrónicas que se consideraban manchas amorfas, al concebirse ocupadas por orbitales atómicos. La más reciente explicación del sistema periódico se da en términos de cuántos de los orbitales atómicos están ocupados por los electrones. La explicación depende del arreglo del electrón, o configuración de un átomo que es descrita hacia el exterior acorde la ocupación de los orbitales.
La pregunta más relevante corresponde a la relación entre la química y la física atómica moderna y en particular la mecánica cuántica. La opinión popular en la mayoría de los libros de texto es que la química no es nada, y sin embargo, es el profundo interior de la física y de todos los fenómenos químicos, especialmente los del Sistema periódico pueden ser desarrollados sobre la base de la mecánica cuántica. Por ejemplo, se sugirió que la explicación de la mecánica cuántica sobre el Sistema periódico está todavía lejos de ser perfecta. Esto es importante porque libros de química, especialmente los dirigidos a la enseñanza, tienden a dar la impresión de que nuestra actual explicación del Sistema periódico está prácticamente completada, pero esto es aún algo impreciso.
La Tabla periódica corresponde a una de las ideas más fructíferas y unificadoras de toda la ciencia moderna, comparable tal vez con la teoría de Darwin de la evolución por selección natural, después de evolucionar durante casi 150 años a través de la aportación de numerosos personajes, la Tabla periódica continua siendo el corazón del estudio de la química esto es primordialmente porque es de gran beneficio práctico para desarrollar predicciones sobre todo tipo de propiedades químicas y físicas de los elementos, y las posibilidades para la formación de enlaces. En lugar de tener que aprender las propiedades de 100 elementos o más, el químico moderno o estudiante de química puede hacer predicciones eficaces del conocimiento de las propiedades de los miembros típicos de cada uno de los ocho grupos principales así como de los grupos englobados por los metales de transición y elementos de las tierras raras.
4.14 Peso atómico, triadas y Prout Dalton
La primera clasificación de los elementos en grupos se llevó a cabo sobre la base de las similitudes químicas entre los elementos, es decir, sobre la base de los aspectos cualitativos más que cuantitativos de los elementos. Por ejemplo, es evidente que los metales litio, sodio y potasio comparten muchas similitudes incluyendo que son suaves, flotan en el agua, y el hecho de que a diferencia de la mayoría de los metales, son capaces de reaccionar visiblemente con el agua.
Pero la Tabla periódica moderna pone en consideración tanto las propiedades cuantitativas como cualitativas de los elementos. La química en su conjunto comenzó a ser un campo cuantitativo, apreciando cuanto reacciona en lugar de como reacciona en las interacciones de los elementos desde los siglos 16 y17. Uno de los responsables de este enfoque fue Antoine Lavoisier, al ser uno de los primeros en realizar medidas exactas del peso de reactivos químicos y sus productos. Haciendo esto, Lavoisier fue capaz de refutar una antigua hipótesis de una sustancia llamada “flogisto” que explicaba la evolución de las sustancias cuando estas eran quemadas.
Por el contrario, Lavoisier descubrió que al quemarse una sustancia, un elemento, resultaba en un aumento en lugar de una disminución del peso. También descubrió que en cualquier operación química, existe una cantidad de materia igual antes y después de desarrollarse la operación, este descubrimiento de la Ley de la conservación de la materia fue seguido por otras leyes de combinación química, en las cuales se exigía una explicación más profunda de las interacciones que tienen lugar, eventualmente estas leyes conducirían al descubrimiento de la Tabla periódica. Lavoisier también mostró las irregularidades en la noción griega del elemento abstracto como portador de propiedades. Él en cambio se concentró en los elementos como la etapa final en la descomposición de cualquier compuesto.
Benjamín Richter, en 1972 mientras trabajaba en Alemania, publicó un listado de elementos con el valor de sus pesos equivalentes. Se trataba de una lista que contenía los pesos de varios metales que hizo reaccionar con una cantidad preestablecida de un ácido estándar, como el ácido nítrico, por ejemplo. Por primera vez, las propiedades de varios elementos podrían ser comparadas con las de otros elementos en una forma cuantitativa sencilla.
4.15 Dalton
En 1801, una joven profesora en Manchester, Inglaterra, publicó los principios de la teoría atómica moderna. Siguiendo las adopciones recientes de Lavoisier, Richter y John Dalton tomó la antigua noción griega de los átomos, las partículas más pequeñas en cualquier sustancia y las hizo cuantificables. No solo asumió que cada elemento consistía en un particular tipo de átomos, sino que también comenzó a estimar sus pesos relativos[17].
Por ejemplo, los dibujo en los experimentos de Lavoisier en la combinación del hidrógeno y el oxígeno para la formación de agua. Lavoisier había demostrado que el agua se componía en un 85% de oxígeno y un 15% de hidrógeno. Dalton propuso que el agua consistía en un átomo de hidrógeno combinado con un átomo de oxígeno de lo que se establecía la formula HO, y que el peso atómico del oxígeno era por lo tanto 85/15=5.66, suponiendo que el peso de un átomo de hidrógeno correspondía a la unidad. El valor actual para el átomo de oxígeno es realmente 16 y la diferencia radica en dos cuestiones que Dalton desconocía. En primer lugar, la formula HO concebida para el agua era incorrecta, ahora como todo el mundo reconoce corresponde a H2O, en segundo lugar, los datos proporcionados por Lavoisier no eran muy precisos.
La noción de pesos atómicos por Dalton confirió una explicación muy razonable para la Ley de las proporciones constantes, es decir el hecho de que cuando los elementos se combinan, lo hacen en una proporción constante de sus pesos. Esta Ley puede considerarse ahora como una versión ascendente de la combinación de dos o más átomos de peso atómico particular. El hecho de que las muestras macroscópicas consisten en un cociente fijo del peso de dos elementos, refleja el hecho de que dos átomos particulares se combinan muchas veces más y una vez que tienen masas particulares, el producto también reflejará esta proporción entre sus masas[18].
Otros químicos, como Dalton lo hizo por sí mismo, descubrieron otra Ley de combinación química, la Ley de las proporciones múltiples. Cuando un elemento A se combina con un elemento B, para la formación de más de un compuesto, hay una proporción sencilla entre la masa de combinación por el elemento B en ambos compuestos. Por ejemplo, carbono y oxígeno se combinan juntos para formar el monóxido de carbono y el dióxido de carbono. El peso del oxígeno combinado en el dióxido de carbono es dos veces más que el peso del oxígeno combinado en el monóxido de carbono. Nuevamente esta Ley encuentra una oportuna explicación en la teoría atómica de Dalton porque implicaba que se había combinado un átomo de carbono con un átomo de oxígeno en el monóxido de carbono CO, mientras que dos átomos de oxígeno se habían combinado con un único átomo de carbono en el dióxido de carbono CO2[19].
4.16 Von Humboldt y Gay-Lussac
En 1809, Alexander Von Humboldt y Joshep- Louis Gay-Lussac descubrieron que al formarse vapor de agua por la interacción de dos gases, el hidrógeno y oxígeno, el volumen de hidrógeno era casi el doble respecto del volumen de oxígeno. Por otra parte, el volumen de vapor de agua formado era equivalente al de la combinación del hidrógeno.
2 volúmenes de hidrógeno + 1 volumen de oxígeno → 2 volúmenes de vapor de agua
Este tipo de comportamiento se encontró era aplicable a otras combinaciones de gases, por lo que Von Humboldt y Gay-Lussac pudieron concluir:
Los volúmenes de gases integrados en una reacción química y los de los productos gaseosos son una proporción de números enteros pequeños.
Esta nueva Ley de la química representó un importante desafío para la naciente teoría atómica de Dalton. Según Dalton, cualquier átomo era absolutamente indivisible, pero esta ley no podría ser interpretada en la asunción de átomos indivisibles de los elementos gaseosos en relación. Solo si los átomos de oxígeno fuesen divisibles en la reacción anterior entre un átomo de oxígeno y dos átomos de hidrógeno presumiblemente se cumpliría la Ley.
La solución a este rompecabezas llegó cuando un físico Amedeo Avogadro, se dio cuenta de que más precisamente eran dos moléculas diatómicas de hidrógeno que se combinaban con una molécula diatómica de oxígeno. Nadie había considerado con anterioridad que estos gases consistieran en dos átomos de un mismo elemento que se combinan para formar una molécula diatómica. Dado que estas moléculas consisten en dos átomos, las moléculas eran divisibles en sus átomos, no los átomos en sí mismos. La teoría de Dalton y la indivisilidad de los átomos todavía podrían ser conservadas y, asumiendo la existencia de moléculas diatómicas de gas que consistían en dos átomos del mismo elemento, la nueva Ley de Humboldt y Gay-Lussac también podría explicarse.
La reacción entre el hidrógeno y el oxígeno se transformó a dos moléculas de hidrógeno diatómico que se separaban en cuatro átomos del mismo elemento, mientras que una molécula de oxígeno diatómico al separarse formaba dos átomos de oxígeno. La formación de dos moléculas de vapor de agua o H2O, implicaría la existencia de los seis átomos en cuestión. Todo esto parece muy simple en retrospectiva, pero dado que las moléculas diatómicas representaron una idea radical y que se desconocía la formula precisa del agua, no es de extrañar que una ecuación simple como:
2H2+O2→2H2O
Llevara unos 50 años antes de que fuera comprendida completamente.
Pero por algún desconocido giro histórico, Dalton se negó a aceptar la idea de moléculas diatómicas porque él creía firmemente que al presentarse dos átomos del mismo elemento cualesquiera que fuesen deberían repelerse y que consecuentemente no podrían formar una molécula diatómica. La idea del enlace químico entre dos átomos de un mismo elemento resultaba novedosa y apenas algunos lograban familiarizarse con la noción y esto resultó especialmente complicado para Dalton, un pionero con una visión tan elaborada del cómo debían comportarse los átomos. Mientras tanto, alguien como Avogadro podría avanzar y postular la existencia de las moléculas diatómicas y liberarse de la concepción de que dos átomos por ser de un mismo elemento tenderían a repelerse, lo que como sabemos no ocurre.
La idea de Avogadro de la formación de moléculas diatómicas, también se vislumbró de modo independiente por André Ampère de quién, el amperio o unidad de corriente toma su nombre. Pero este descubrimiento crucial se mantuvo inadvertido por más de 50 años hasta que finalmente fue resucitado por Stanislao Canizzaro.
4.17 Hipótesis De Prout
Unos años después de que Dalton y otros habían publicado sus listados de pesos atómicos, William Prout notó que muchos de los pesos atómicos determinados para los elementos parecían ser múltiplos enteros del número de peso del átomo de hidrógeno. Su conclusión fue algo obvia, tal vez todos los átomos estarían últimamente compuestos de átomos de hidrógeno. Si esto fuera verdad, se postularía también la unidad de toda la materia a nivel fundamental, una noción basta desde los albores de la filosofía griega y que ha resurgido repetidamente con algunas modificaciones.
Pero no todos los pesos atómicos publicados correspondían a múltiplos exactos del peso del átomo de hidrógeno. Prout no había esclarecido la razón de las evasiones a la secuencia característica, pero sugirió que la causa radicaba en el hecho de que el peso de esos átomos aberrantes no habían sido aún determinados con precisión. La hipótesis de Prout, como llegó a ser conocida, fue fructífera debido a que permitió a otros hacer mediciones de los pesos atómicos con mayor exactitud en lugar de limitarse a mostrar su apoyo o desaprobación. Consiguientemente el refinamiento de pesos atómicos más precisos jugaría un papel fundamental en el descubrimiento y evolución de la Tabla periódica.
Pero el consenso inicial de la hipótesis de Prout fue equivocado. Los pesos atómicos medidos con mayor exactitud sugerían que, en realidad los átomos de los elementos no eran múltiplos exactos del átomo de hidrógeno. Sin embargo, la hipótesis de Prout fue destinada a hacer una reaparición más adelante en la historia, aunque se presentaría en una forma modificada.
4.18 Triadas De Döbereiner
El químico Wolfgang Döbereiner descubrió otro de los principios generales que contribuyeron a la necesidad de medir con exactitud los pesos atómicos de los elementos y así forjó el camino para la Tabla periódica. Comenzando en 1817, Döbereiner descubrió la existencia de varios grupos de elementos en los que uno de sus elementos poseía propiedades químicas y un peso atómico que correspondían aproximadamente al promedio de otros dos de sus elementos integrantes. Estos grupos de tres elementos se denominaron tríadas. Por ejemplo, el litio, sodio y potasio son metales suaves de coloración gris de bajas densidades. El litio muestra una reacción disminuida con el agua, mientras que el potasio es altamente reactivo en interacción con esta. Pero el sodio muestra una reactividad intermedia en comparación con los otros dos miembros de la tríada.
Además el peso atómico del sodio (23) es intermedio entre los pesos del litio (7) y potasio (39). Este descubrimiento fue muy importante porque mostró el primer indicio de una regularidad numérica distribuida en el corazón de las relaciones entre la naturaleza y las propiedades físicas y químicas de los elementos. Se sugirió un orden matemático subyacente respectivo a como los elementos estaban relacionados químicamente entre sí.
Otra de las tríadas claves reconocidas por Döbereiner consistió en tres de los elementos halógenos cloro, bromo y yodo. Pero Döbereiner no intentó colocar estas diferentes tríadas juntas de alguna manera. Lo habría hecho de habérselo propuesto, él podría haber descubierto la Tabla periódica 50 años antes que Mendeleev y otros lo hicieran.
En la identificación de varias tríadas, Döbereiner exigía que existiese una similitud química entre los tres elementos en cuestión, además de las proporciones matemáticas descritas. Otros autores que lo siguieron, no se mostraban tan inquietados por esta primera condición, atraídos por las equivalencias en términos numéricos abandonaban el sentido químico estricto, y muchos de ellos creyeron haber descubierto muchas otras tríadas. Por ejemplo, en 1857 Ernst Lenssen publicó un artículo en el que prácticamente todos los 58 elementos hasta entonces conocidos se disponían en un total de 20 tríadas. Diez de sus tríadas consistían en no metales y metales formando ácidos, y las diez restantes las integraban solo metales.
Guiándose por la disposición de 20 tríadas en la Tabla, Lenseen también pretendía la identificación de un total de siete supertríadas, lo que se traducía a que el peso equivalente medio de la Tabla se encontraba aproximadamente a medio camino entre los pesos promedios de las otras tríadas, estas correspondían a tríadas de tríadas por así plantearse, pero su sistema resultaba forzado, pues no todas las tríadas se presentaban genuinamente, algunas como la del hidrógeno eran representadas por este único elemento, por un asunto de mera conveniencia.
Otro de los sistemas de clasificación de los elementos obedecía a Leopold Gmelin, que mientras desarrollaba sus trabajos descubrió algunas nuevas tríadas e inició un esfuerzo para relacionarlas juntas para la formación de un sistema general con una forma distintiva de cada uno de los elementos. Su sistema integraba como mucho 55 de los elementos y en previsión de los sistemas anteriores parece que Gmelin ordenó la mayor parte de los elementos en el orden creciente de sus pesos atómicos, aunque nunca expresó explícitamente esta noción.
Sin embargo, el sistema postulado por Gmelin no puede ser considerado como un Sistema periódico ya que no muestra la repetición periódica de las propiedades de los elementos. En otras palabras, las propiedades periódicas químicas que confieren el nombramiento de la Tabla periódica no fueron representadas aún, Gmelin transformó su sistema de ordenación de los elementos en una estructuración de su libro de texto de química englobando 500 o más páginas. Esta fue la primera ocasión en que una Tabla de elementos sentó las bases para el desarrollo de un libro completo de química.
4.19 Kremers
Una Tabla periódica moderna representa mucho más que una colección de grupos de elementos con propiedades químicas similares. Además de las que pueden ser llamadas “relaciones verticales” que incorporan las tríadas de los elementos, una Tabla periódica moderna une grupos de elementos en una secuencia ordenada.
Una Tabla periódica consiste en una dimensión horizontal, que contiene diferentes elementos, así como una dimensión vertical que presenta elementos con similitudes químicas. La primera persona en considerar una relación horizontal fue Peter Kremers, quién notó una regularidad corta en una serie de elementos en la que se integraba al oxígeno, azufre, titanio, fósforo y selenio.
Desde un punto de vista moderno, estas tríadas pueden no parecer químicamente significativas. Pero esto es debido al formato medio largo del Sistema periódico que no muestra las similitudes secundarias entre los elementos. El sulfuro y titanio, ambos muestran una valencia de cuatro por citar un ejemplo, no aparecen en el mismo grupo en el formato medio largo del Sistema periódico. Pero no es sobrevalorado considerarlos como químicamente análogos. Dado que el titanio y fósforo muestran usualmente valencias de tres, su agrupación no sería significativamente incorrecta como podría parecer en una primera impresión. Pero en términos generales, como en el caso de Lenssen esto corresponde a un intento desesperado de crear forzadamente nuevas tríadas. El objetivo parece haberse convertido en encontrar una tríada de relaciones entre los pesos independientes de los elementos, independientemente de si estos presentaban o no una trascendencia química. Mendeleev más tarde describió esta actividad entre sus colegas como un obsesionamiento con las tríadas, que él percibía había retrasado el descubrimiento de un Sistema periódico maduro.
La contribución más incisiva de Kremers residía en la sugerencia de un esquema bidireccional de lo que él llamó, “conjugado de tríadas”.
Li 6.5 |
Na 23 |
K 39.2 |
Mg 12 |
Zn 32.6 |
Cd 56 |
Ca 20 |
Sr 43.8 |
Ba 68.5 |
Por lo tanto de una manera más profunda que cualquiera de sus predecesores, Kremers estaba comparando elementos químicamente diferentes, una práctica que solo llegaría a plena madurez con Tablas como las de Lothar, Meyer y Mendeleev[20].
4.20 Pasos de la Tabla Periódica
La década de 1860 representó una época importante para el descubrimiento de la Tabla periódica. Comenzó con un congreso en Karlsruhe, Alemania para resolver una serie de cuestiones técnicas en el comprendimiento químico del concepto de átomos y moléculas. La Ley de la combinación de los gases Por Gay-Lussac fue esclarecida, mientras se mantenía en la superficie por ser blanco de críticas significativas por Dalton, en su concepción presentó una amplia aceptación debido en parte a la defensa de Canizzaro, un compatriota de Avogadro que había sugerido esta idea desde 50 años atrás.
Otro problema lo ha representado el hecho de que diversos autores confirieron diferentes valores a los pesos atómicos de los elementos. Canizzaro también tuvo éxito en producir un conjunto racionalizado de dichos valores que plasmó en forma de folleto que distribuyó a los delegados de la conferencia. Provistos de estas concesiones, resultaba solo cuestión de tiempo antes de que seis científicos individuales desarrollaran Sistemas periódicos rudimentarios que integraban a los 60 elementos conocidos y reconocidos.
4.21 De Chancourtois
La primera persona en descubrir plenamente la periodicidad química de los elementos fue Émile Béguyer De Chancourtois, que desarrolló un acomodo de los elementos en el orden creciente de sus pesos atómicos en una espiral inscrita alrededor de un cilindro de metal. Después de hacerlo se dio cuenta de que elementos químicamente similares cayeron sobre las líneas verticales, que cruzaban la espiral circundando al cilindro. Este fue el espacio del descubrimiento fundamental de los elementos, cuando en su orden natural, parecían repetir sus propiedades aproximadamente después de ciertos intervalos regulares. Justo como las notas de una escala musical, la periodicidad o repetición parece ser una propiedad esencial de los elementos. La causa subyacente de la periodicidad química permanecería como un misterio por muchos años más.
De Chancourtois expresó su apoyo a la hipótesis de Prout y fue tan trascendente que redondeó los valores de los pesos atómicos para la integración de números enteros en su Sistema periódico. El sodio con un peso de 23, aparecía en su sistema dando una vuelta entera respecto del litio, con un peso atómico de 7. En el siguiente grupo colocó elementos como el magnesio, calcio, hierro, estroncio, uranio y bario. En el Sistema periódico cuatro de estos elementos magnesio, calcio, estroncio y bario se mantienen en el mismo grupo. La inclusión del hierro y uranio parece en una primera impresión un error absoluto pero en el formato corto de las primeras Tablas periódicas algunos elementos de transición se incluían en lo que conocemos ahora como elementos del grupo principal. Un aspecto desafortunado fue el no incluir un diagrama representativo de su sistema, esta omisión resultó fatal, dado que la representación gráfica es un aspecto crucial de cualquier sistema periódico. Para solucionar este problema, De Chancourtois más tarde publicó un documento privado, pero sin lograr una distribución generalizada del mismo y como consecuencia permaneció en la oscuridad ante la comunidad química de esos días.
El descubrimiento de De Chancourtois no fue reconocido en gran parte porque estaba adelantado su tiempo. De hecho, incluso después de que Mendeleev había alcanzado una fama enaltecida por su propio Sistema periódico publicado en 1869, la mayoría de los químicos no eran conscientes aún del trabajo de De Chancourtois. Entonces, finalmente en 1892, 30 años después de la aparición del trabajo innovador de De Chancourtois, tres químicos reunieron esfuerzos para tratar de resucitar su trabajo.
Philip Hartog al notar inconsistencias en las afirmaciones de Mendeleev quién desacreditaba el trabajo de De Chancourtois al sostener que este no había creado un Sistema periódico natural como el propio de Mendeleev. Hartog publicó un documento en apoyo al trabajo de De Chancourtois. Mientras que Paul Émile Le Coq De Boisbaudran y Albert Auguste Lapparent hicieron declaraciones similares apelando al reconocimiento de su compatriota en un esfuerzo por restaurar su honor.
4.22 Newlands
En 1863, un año después de la publicación del trabajo de De Chancourtois, John Newlands publicó su primera clasificación de los elementos. Sin hacer uso de los pesos atómicos de Canizzaro de los que él era inconsciente. Newlands colocó entonces los elementos conocidos en 11 grupos cuyos miembros mostraban propiedades análogas, además señaló que sus pesos atómicos diferían por algún múltiplo o factor de 8.
Por ejemplo, su grupo 1 consistía en los elementos litio (7), sodio (23), potasio (39), rubidio (85), cesio (123) y talio (204) desde una perspectiva moderna, solo el talio presentaría una disposición incorrecta ya que pertenece a otro grupo en unión con el boro, aluminio, galio e indio. El elemento talio había sido recientemente descubierto apenas un año antes por William Crookes. La primera persona en colocarlo correctamente en el grupo del Boro fue el codescubridor del Sistema periódico, Julius Lothar Meyer. Incluso el gran Mendeleev había distorsionado la posición del talio en sus primeras Tablas periódicas y, como Newlands lo colocaba entre los metales alcalinos.
En su primer artículo sobre la clasificación de los elementos Newlands indicó la siguiente observación sobre el grupo de los metales alcalinos.
La relación entre los equivalentes de este grupo, puede ser quizá expresada más simplemente de la siguiente manera 1 litio (7)+ 1 potasio (39)= 2 sodio (23).
Esto correspondió, por supuesto a un redescubrimiento de las relaciónes entre los elementos en una tríada.
Li 7 |
Na 23 |
K 39 |
2 Na (23)=7+39
En 1864, Newlands comenzó a publicar una serie de artículos en los que un poco a tientas intentaba emprender un camino que le permitiese mejorar su Sistema periódico y que encontrado más tarde llamó Ley de octavas, es decir la idea de que los elementos presentan repeticiones al evaluarlos en secuencias de ocho. En 1865 incluyó 65 elementos en su sistema utilizando números ordinales en lugar de los pesos atómicos como principio rector en el ordenamiento de los elementos en una secuencia por aumento de peso.
El nombramiento de Ley de octavas y su analogía de índole musical no fue admirada por las sociedades académicas y al no ser Newlands un químico catedrático, su idea fue ridiculizada al presentarla verbalmente ante la Royal Society of Chemistry en 1866. Un miembro de la austera audiencia preguntó a Newlands si él había considerado ordenar los elementos por orden alfabético lo que no mejoró la situación. El documento de Newlands no fue publicado en las actas de dicha sociedad, aunque si publicó más artículos en algunas revistas químicas incluyendo la publicación de subsecuentes Tablas periódicas, defendiendo siempre la Ley de las octavas.
4.23 Odling
Otro de los químicos con publicaciones tempranas de la Tabla periódica William Odling, un destacado químico académico reconocido por importantes entidades como Oxford y The Royal Institution, en Londres. Odling publicó independientemente su propia versión de la Tabla periódica organizando los elementos en el orden creciente de su peso atómico, como lo había hecho Newlands y mostrando a los elementos con similitudes químicas en columnas verticales.
En un documento escrito en 1864, Odling declaró que:
Al arreglar los pesos atómicos o números proporcionales de los 60 elementos reconocidos, en orden de sus varias magnitudes, se observaba una marcada continuidad en la serie aritmética resultante.
Esto fue proseguido por una declaración adicional:
Con que facilidad esta seriación puramente aritmética podría hacerse de acuerdo a un arreglo horizontal de los elementos según sus agrupaciones generalmente recibidas, en la Tabla podría mostrarse, que las tres primeras columnas de la secuencia numérica sería perfecta, mientras que en los restantes las irregularidades no serían pocas ni triviales.
No está claro porque el descubrimiento de Odling no fue aceptado, pero en apariencia el mismo Odling carecía de entusiasmo por la concepción de la periodicidad química y se mostraba reacio a creer en la existencia de una Ley oculta en la naturaleza.
4.24 Hinrichs
Gustavus Hinrichs desarrolló su propio sistema de clasificación de los elementos publicado en un novedoso formato radial. Sin embargo, la escritura Hinrichs tendía a envolverse en misteriosas capas alusivas a la mitología griega y otros excesos excéntricos, aunque su alineación con sus colegas y comunidad principal de químicos no estaba comprometida. Publicó su primer libro a los 20 años, mientras asistía a la universidad de Copenhague, para luego ser nombrado jefe de lenguas modernas en la University of Lowa y un año más tarde volverse profesor de Filosofía natural, Química y Lenguas modernas, también se le atribuye la fundación de la primera estación meteorológica en Estados Unidos donde fungió como su director por 14 años.
La amplia gama de intereses de Hinrichs se extendió a la astronomía, como muchos autores antes que él, desde los tiempos de Platón, Hinrichs había notado regularidades numéricas en los tamaños de las órbitas planetarias. En un artículo publicado en 1864, se mostró la siguiente figura, que él procedió a interpretar.
Distancia al sol |
Mercurio 60 |
Venus 80 |
Tierra 120 |
Marte 200 |
Asteroides 360 |
Júpiter 680 |
Saturno 1320 |
Urano 2600 |
Neptuno 5160 |
|
Tabla 1. Hinrichs de las distancias planetarias (1864)
Las diferencias expresadas en estas distancias por la formula 2X×n, donde n es la diferencia entre las distancias de venus y mercurio respecto del sol, o 20 unidades. Dependiendo del valor de X, la fórmula expresaría las siguientes distancias.
20×20=20
21×20=40
22×20=80
23×20=160
24×20=320
Etc.
Unos años antes en 1859, Gustav Kirchoff y Robert Bunsen descubrieron que cada elemento podría hacerse emitir luz sí estos pudiesen ser dispersados en un prisma de vidrio lo que permitiría un análisis cuantitativo. También descubrieron que cada elemento mostraba un espectro único consistente en un conjunto de líneas espectrales, sobre las que fijaron una medición que fue publicada en tablas elaboradas. Algunos autores sugieren que estas líneas espectrales pueden proporcionar información sobre los distintos elementos por los que habían sido producidas, pero estas sugerencias se reunieron con las severas críticas de uno de sus descubridores, Bunsen que se mantenía opuesto a la idea de estudiar los espectros de los elementos para el estudio de los átomos y obtener conocimientos que permitieran clasificarlos de alguna manera.

4.25 Sistema periódico de Hinrichs
Hinrichs, sin embargo, no mostró dudas en la conexión de los espectros con los átomos de los elementos. En particular, se interesó por el hecho de que, en cualquier elemento particular, las frecuencias de sus líneas espectrales siempre aparecían como múltiplos de números enteros de la menor de las diferencias. Por ejemplo, en el caso del calcio, una proporción de 1:2:4 había sido observada en su frecuencia de líneas espectrales. La interpretación de Hinrichs a este hecho era audaz y elegante, los tamaños de las órbitas planetarias producen una serie de números enteros, y las relaciones entre las líneas espectrales de los elementos también producían relaciones de números enteros, el fundamento en esta última condición pudo mentir en las relaciones de tamaño entre las dimensiones atómicas de varios de los elementos.
Los once rayos irradiando desde el centro del sistema de rueda de Hinrichs consistieron en tres grupos predominantes de elementos que agrupaban no metales y ocho grupos que incluían elementos metálicos. Desde una perspectiva moderna, los grupos que integraban elementos no metales aparecían ordenados incorrectamente, en la secuencia de los grupos 16, 15 y 17 procediendo de izquierda a derecha en la parte superior del espiral. El grupo que contiene el carbono y silicio se clasificaría en los grupos metálicos por Hinrichs, presumiblemente por incluir metales como como el níquel, paladio y platino. En la Tabla periódica moderna estos tres metales son de hecho agrupados juntos, pero no el grupo que integra al carbono y silicio sino que pertenecen al grupo 14 junto con el germanio, estaño y plomo.
Sin embargo, en general el Sistema periódico de Hinrichs fue bastante exitoso al agrupar muchos elementos importantes. Una de sus principales ventajas es la claridad de sus agrupaciones, respecto a otros más elaborados pero menos exitosos Sistemas periódicos como el presentado por Newlands en 1864 y 1865. Hinrichs poseía un profundo conocimiento de la química, así como a nivel de mineralogía. Tal vez fue el más interdisciplinar de todos los descubridores del Sistema periódico, mostrando otra faceta de la individualidad y honorabilidad de los aportes de los pioneros del sistema periódico.
En un artículo publicado por The Pharmacist en 1869, Hinrichs abordaba los anteriores intentos de clasificar los elementos, pero al hacerlo, evadió hacer mención de descubridores predecesores como De Chancourtois, Newlands, Odling, Lothar Meyer o Mendeleev. Uno de los atributos recalcables en la concepción de Hinrichs respecto a intentos predecesores corresponde en apariencia al haber omitido por completo el principio generalizado de clasificación de los elementos directamente por su peso atómico.
4.26 Lothar Meyer
El primer Sistema periódico en tener algo de impacto en el mundo científico fue debido al químico Julius Lothar Meyer. Su trabajo representó en parte la culminación del trabajo de Mendeleev pero evidencias sugieren que por méritos propios podría ser considerado codescubridor del sistema periódico. Presentado en 1862, solo dos años después de Karlsruhe, dos Tablas periódicas parciales, una de ellas compuesta por 28 elementos dispuestos en orden creciente respecto de su peso atómico en el que los elementos se agrupaban en columnas verticales según sus valencias químicas.
En 1864, publicó un influyente libro de química teórica en el que se integraban ambas tablas, la segunda Tabla se componía de 22 elementos y en parte estaba estructurada por el orden creciente del peso atómico de sus elementos.
Lothar Meyer fue uno de los teóricos o físico químicos en poner mayor énfasis en las determinaciones cuantitativas de cantidades como densidades, volúmenes atómicos y puntos de fusión de los elementos que en sus propiedades químicas. Aunque dejó algunas lagunas en sus Tablas periódicas, se aventuró a predecir algunas de las propiedades de los elementos que eventualmente podrían llenar estos espacios. Una de sus predicciones correspondió al descubrimiento de un elemento aislado en 1886 nombrado germanio. A diferencia de Mendeleev, Lothar Meyer era partidario de la hipótesis de Proust de la composición fundamental de los elementos y creía en la existencia de una unidad esencial de toda la materia. En 1868 produjo un Sistema periódico ampliado para la segunda edición de su libro que incluía 53 elementos, pero por cuestiones académicas esta no llegó a ser publicada.
La Tabla periódica de Lothar Meyer tiene gran mérito por su inclusión de muchos elementos, así como ciertas disposiciones que el famoso cuadro de Mendeleev publicado en ese mismo año no llegó a alcanzar. Finalmente se publicó la tabla perdida, posterior a la muerte de Lothar Meyer en 1895 siendo demasiado tarde para tener algún impacto acerca de quien había sido el pionero nato del primer Sistema periódico maduro. Mendeleev siempre mantuvo un enfoque más enérgico alegando que el crédito pertenecía a sí mismo porque él había ido más allá del descubrimiento del sistema periódico haciendo un número de predicciones exitosas.
4.27 El genio ruso, Mendeleev
Dimitri Ivanovich Mendeleev es por mucho el científico más famoso de la era moderna. No solo descubrió el sistema periódico, sino que reconoció la expresión de una ley profunda en la naturaleza, la Ley periódica. A él también le tomó muchos años esclarecer todas las consecuencias de esta Ley, en particular por la predicción de la existencia y propiedades de muchos de los elementos recientemente descubiertos. Además el corrigió los pesos atómicos de algunos de los elementos ya conocidos y había modificado correctamente el acomodo de algunos elementos en la Tabla periódica.
Pero quizás lo más importante de todo fue la construcción de una Tabla periódica propia prosiguiendo con su estudio y desarrolló durante varios periodos de su vida, incluso a través de sus aportaciones en un número de diversos campos de la ciencia. Por el contrario, la mayoría de sus predecesores o codescubridores que no dieron un seguimiento a sus descubrimientos iniciales. Como resultado el nombre de Mendeleev es indisociable de la Tabla periódica al igual que la teoría de la evolución por selección natural lo es de Darwin o la teoría de la relatividad lo es de Einstein.
Su formación científica comenzó en el Pedagogical Institute of St Petersburg, donde comenzó a estudiar química, física, biología y por supuesto pedagogía, esta última tendría un papel revelador en el descubrimiento de un Sistema periódico maduro. En 1861, Mendeleev empezó a representar una promesa real al publicar un libro sobre química orgánica, que lo hizo merecedor del codiciado premio Demidov en Rusia. En 1865, defendió su tesis doctoral sobre la interacción entre el alcohol y el agua, y comenzó a trabajar en un libro sobre química inorgánica con el fin de mejorar la enseñanza de la química, abordando en el primer capítulo a los elementos más comunes sin ningún orden particular.
4.28 El descubrimiento real
Si bien Mendeleev había estado pensando acerca de los elementos, sus pesos atómicos y su clasificación por unos diez años, parece haber tenido su momento de brillantez o quizá un día más específicamente el 17 de febrero de 1869. En este día, canceló todos sus pendientes y decidió trabajar en lo que sería su más celebre pequeño cerebro, la Tabla periódica.
En primer lugar, enumeró los símbolos de un puñado de elementos en dos filas en la parte posterior de una tarjeta gourmet.
Na |
K |
Rb |
Cs |
Be |
Mg |
Zn |
Cd |
Entonces produjo una variedad ligeramente mayor de 16 elementos.
F |
Cl |
Br |
I |
|
|
|
|
Na |
K |
Rb |
Cs |
|
|
Cu |
Ag |
Mg |
Ca |
Sr |
Ba |
Zn |
Cd |
|
|
Para la noche, Mendeleev había bosquejado una Tabla periódica completa que incluía los 63 elementos conocidos. Además se reconocían espacios vacíos para los elementos todavía desconocidos e incluso se integraban algunos pesos atómicos predichos para estos elementos. Doscientas copias de esta primera Tabla periódica fueron impresas y distribuidas a los químicos en toda Europa, su descubrimiento fue anunciado ante la Russian Chemical Society, por lo que en el transcurso de un mes había aparecido en un uno de sus artículos y en periodo un poco más largo que apareció en Alemania.
Mendeleev pareció diferenciarse considerablemente de su rival Lothar Meyer al no creer en la existencia de una unidad de toda la materia y rechazar la hipótesis de Prout de la naturaleza compuesta de todos los elementos. Mendeleev también cuidó mantenerse distanciado de la noción de las tríadas de los elementos. Por ejemplo propuso que el elemento flúor debía agruparse junto con el cloro, bromo y yodo aunque esto implicaría ir más allá de una tríada para formar un grupo de al menos cuatro elementos.
Mendeleev parecía prestar especial atención a las propiedades químicas de los elementos, sin embargo cuando llegó el momento de elegir su principio rector para la clasificación de los elementos insistió en que el ordenamiento de los elementos por su peso atómico no toleraría excepciones. Por supuesto, muchos de los predecesores de Mendeleev como De Chancourtois, Newlands, Odling y Lothar Meyer habían reconocido la importancia del peso atómico en el ordenamiento de los elementos en diferentes grados. Pero Mendeleev también alcanzó una comprensión filosófica de los pesos atómicos y de la naturaleza de los elementos que le permitió moverse en un territorio desconocido de los elementos todavía desconocidos.
4.29 La naturaleza de los elementos
Existe un rompecabezas desde hace muchos años en la química como parte su concepción. Al combinarse el sodio (metal altamente reactivo) y cloro (gas tóxico), dan lugar a una sustancia completamente nueva, el cloruro de sodio, en la que los elementos combinados parecen desaparecer, al menos desde su perspectiva visual, aunado a esto su gran capacidad reactiva individual parece agotarse en un producto inocuo que ha acompañado a la humanidad desde la aparición de las primeras operaciones unitarias reconocidas por el hombre. Este es el fenómeno de la vinculación química o combinación química, que difiere notablemente de una mezcla física de lo que podría ser azufre en polvo y limaduras de hierro. Uno de los cuestionamientos sobre la combinación química es el entendimiento de como los elementos en combinación sobreviven en un compuesto formado. Este tema puede complicarse al abordarse en varios idiomas como el Inglés, en el que se emplea el término “elemento” para referirse a una sustancia en combinación, como el cloro cuando está presente en forma de cloruro de sodio. Ahora lo que subyace a ambos, el cloro como gas verde sin combinar y cloruro en combinación es denominado elemento. Ahora se presentan tres sentidos del mismo término químico central para describir las sustancias en la Tabla periódica que se disponen a clasificar.
El tercer sentido de “elemento”, ha sido llamado elemento metafísico, elemento abstracto, elemento trascendental y más recientemente “elemento como sustancia básica”. Este es el elemento que carece de propiedades fenomenales como un abstracto portador de propiedades elementales tales como la coloración verde del cloro. El cloro verde es presentado como sustancia simple.
Cuando Antoine Lavoisier revolucionó la química a finales del siglo XVII, uno de sus aportes fue concentrar la atención en los elementos como sustancias simples, es decir un elemento de forma aislada. Esto se destinaría al mejoramiento de la química, librándola del exceso de equipaje metafísico representando un hecho trascendental. Ahora un “elemento” sería considerado principalmente como el paso final en la separación de los componentes de cualquier compuesto.
Sin embargo el sentido abstracto no fue olvidado y Mendeleev fue uno de los químicos que no solo lo entendía sino que pretendía elevar su condición. De hecho afirmaba repetidamente que el Sistema periódico es sobre todo una clasificación de este sentido más abstracto del término elemento como sustancia pura. Y no necesariamente el elemento más concreto podría ser aislado de un compuesto, lo que amplió de modo significativo sus perspectivas respecto a los químicos que están más acostumbrados o prefieren pensar a los elementos en forma aislada.
4.30 Predicciones De Mendeleev
Uno de sus mayores triunfos y quizás uno de los que mejor se recuerdan, es la predicción correcta de Mendeleev de la existencia de varios nuevos elementos. Además, corrigió los pesos atómicos de algunos elementos, así como desarrolló una modificación exitosa en la disposición de algunos elementos en la Tabla periódica. Mendeleev pudo superar obstáculos evidentes que surgieron al tomar las propiedades de los elementos aislados a valor nominal.
Si bien Mendeleev colocó de manera central el peso atómico de los elementos, también consideró propiedades físicas y químicas entre ellos, y las semejanzas entre sus familias. Otro de los criterios que utilizó fue que cada elemento debía ocupar un único lugar en la tabla periódica, aunque estaba dispuesto a violar esta noción propia en el que llamó grupo VIII. Sin embargo su criterio más importante fue el ordenamiento de los elementos según el orden creciente de sus pesos atómicos. En uno o dos casos parecía incluso violar este principio aunque una inspección más profunda demuestra que este no era de hecho el caso.
En el caso del telurio y el yodo es uno de los cuatro pares de inversiones en el Sistema periódico, y el más conocido entre ellos. Estos son elementos que parecen estar en el orden inverso del que les correspondería por el valor creciente de sus pesos atómicos (Te= 127.6, I=126.9, Y Te aparecía antes que I). Muchos relatos históricos expresan la habilidad incrementada de Mendeleev al explicar ingeniosamente estas inversiones proponiendo propiedades químicas más allá de las que corresponderían a los elementos según su peso atómico. Pero como sabemos esto era incorrecto, limitándose a representar el renacer de las aberraciones mostradas por algunos de sus predecesores. De algún modo al infringir su propio criterio de un sistema sin cabida a excepciones Mendeleev justificaba este acomodo al proponer que uno o ambos de los pesos atómicos de los elementos habían sido determinados incorrectamente. En este punto como en muchos otros notificados Mendeleev estaba equivocado.
En el momento que Mendeleev propuso sus primeros Sistemas periódicos, los pesos atómicos para el telurio y el yodo eran probablemente 128 y 127 respectivamente. La creencia de Mendeleev del peso atómico como principio fundamental del ordenamiento de los elementos lo restringían a defenderlo así, pero permanecía la interrogante sobre la relación y exactitud de estos dos valores. Esto puesto que estaba claro que en términos de similitudes químicas el telurio debía agruparse con los elementos del grupo VI y el yodo con los elementos del grupo VII revirtiendo la inversión. Mendeleev dudaba del peso atómico del telurio y se mostraba más confiado en el peso del yodo, por lo que en algunas de sus Tablas periódicas subsecuentes el telurio aparecía con un peso atómico de 125, manteniendo su fidelidad al ordenamiento de los elementos por su peso atómico por el resto de su vida.
Al mismo tiempo, aseveró que el valor comúnmente divulgado del peso atómico del telurio de 128 fue resultado de mediciones de una mezcla de elementos proponiendo un nuevo elemento que llamó eka-telurio, su presencia representaría la discrepancia en la determinación. Motivado por estas afirmaciones Bohuslav Brauner comenzó una serie de experimentos hacia 1880 encaminados a determinar el peso atómico del telurio. Sus resultados parecían reforzar la conclusión de Mendeleev al encontrar un peso atómico de 125 para el telurio.
Pero en 1895, todo cambió cuando el mismo Brauner comenzó a reportar un peso atómico para el telurio que superaría al del yodo, volviendo así al punto de partida de las cuestiones iniciales. La respuesta de Mendeleev consistió en retrospectiva a la evaluación el peso atómico del yodo, solicitando su redeterminación y esperando que su valor superara al del telurio. En algunas de sus Tablas periódicas posteriores este aparecía con un peso atómico de 127.
El problema no sería resuelto hasta los aportes de los trabajos desarrollados por Henry Moseley en 1913 y 1914, quién demostró que el ordenamiento ideal de los elementos en su disposición en el Sistema periódico sería por su número atómico y no por su peso atómico. Mientras que el telurio posee un mayor peso atómico que el yodo, tiene un número atómico más bajo y por esto debe ser colocado antes del yodo en completo acuerdo con su comportamiento químico.
Aunque las predicciones de Mendeleev pueden en una primera apreciación parecer milagrosas, de hecho fueron basadas en la cuidadosa interpolación entre las propiedades de los elementos que flanqueaban la periferia de los elementos desconocidos. Comenzó a hacer predicciones de las propiedades químicas y físicas desde su primera postulación del sistema periódico en 1869, en su documento escribió:
Debemos esperar el descubrimiento de elementos aún desconocidos, por ejemplo, elementos análogos al Al y Si, con pesos atómicos de 65 y 75.
Tomó casi 15 años la aparición del primer elemento previsto por Mendeleev, nombrado como galio. Con muy pocas excepciones, sus predicciones eran casi exactamente correctas. La exactitud de las predicciones de Mendeleev también pueden observarse en el germanio, elemento aislado por Clemens Winkler. Parecía que lo que faltó a Mendeleev estribó en estimar la gravedad específica del tetracloruro de germanio.
4.31 Predicciones fallidas de Mendeleev
No todas las predicciones de Mendeleev eran tan espectacularmente acertadas, un aspecto parece haber sido omitido a conveniencia en la historia de la Tabla periódica. Nueve de sus dieciocho predicciones representaban un fracaso en diferentes grados. Algunos como los elementos de las tierras raras con semejanzas muy cercanas, plantearon un reto en su disposición en la Tabla periódica por muchos años. Estas fallas plantearon una cuestión filosófica sobre el mérito en los avances científicos de las predicciones sobre valores demostrados.
Predicciones de Mendeleev acertadas o no
En el momento del descubrimiento de la Tabla periódica, aún no habían sido instituidos los premios Nobel. Uno de los más altos reconocimientos en química correspondía al mérito de la medalla Davy, otorgada por la Royal Society of Chemistry en Gran Bretaña nombrada en honor al químico Humphry Davy. En 1882, la medalla Davy fue concedida conjuntamente a Lothar Meyer y Mendeleev. Este hecho parece sugerir que los eminentes químicos británicos que otorgaron el premio no encontraron demasiado impresionantes las predicciones exitosas de Mendeleev, ya que estaban dispuestos a reconocer a Lothar Meyer que no había postulado ninguna predicción, estas fueron omitidas de la citación detallada en su nombramiento.
4.32 Los Gases inertes
El descubrimiento de los gases inertes a finales del siglo XIX representó un reto interesante para el Sistema periódico. En primer lugar, a pesar de las predicciones un tanto dramáticas de Mendeleev de muchos otros elementos, falló totalmente al no predecir este grupo entero de elementos (He, Ne, Ar, Kr, Xe, Rn), aunque nadie predijo estos elementos o incluso sospechó de su existencia.
El primero de ellos en ser aislado fue el argón en 1984, en la University College de Londres. Una serie de factores conspiraron juntos para el alojamiento de este elemento de compromiso hercúleo. No fue hasta seis años después de su descubrimiento que los gases inertes tomaron su lugar como octavo grupo entre los halógenos y los metales alcalinos.
El argón fue obtenido en pequeñas cantidades por Lord Rayleigh y William Ramsey que trabajaban con nitrógeno gaseoso. No resultó sencillo determinar el valiosísimo peso atómico del argón que debía ser integrado en la Tabla periódica. Esto debido a que la atomicidad del argón era en sí misma algo difícil de determinar, pero todos los gases conocidos correspondían a elementos diatómicos (H2, N2, O2, F2, Cl2). Si el argón correspondía a un elemento monoatómico, su peso atómico sería aproximadamente de 40, pero esto representaba un acomodo problemático en la Tabla periódica, puesto que no existía ningún espacio vacío para este valor de peso atómico. El elemento calcio aparecía con un peso atómico de 40, seguido por el escandio, uno de los elementos correctamente predichos por Mendeleev con un peso atómico de 44, lo que parecía descartar la inclusión del argón en la Tabla periódica con un peso atómico de 40.
Había una brecha bastante grande entre el cloro (35.5) y potasio (39), pero de haber colocado al argón entre estos elementos habría empeorado su incomprensión, que con su solo descubrimiento en ese tiempo representó el blanco de severas críticas por la Sociedad científica. Sin embargo otro de los aspectos inusuales del elemento argón residía en su completa inercia química, lo que significaba que sus compuestos no podrían ser estudiados, por la sencilla razón de que no formaba compuestos. Algunos investigadores tomaron la inercia de los gases nobles en el sentido de que estos no correspondían a elementos químicos genuinos. De ser cierto, proporcionaría la resolución del dilema de la disposición del elemento en la Tabla periódica al no corresponderle ningún lugar específico por sus propiedades anómalas.
Pero muchos otros persistieron en sus esfuerzos de colocar al elemento en la Tabla periódica. El alojamiento del argón fue el centro de atención en una de las reuniones de Royal Society en 1885 reuniendo en ella a los principales y más prestigiados químicos y físicos del día. Los descubridores del argón, Rayleigh y Ramsey, sostuvieron que el elemento era probablemente monoatómico, pero admitían su incapacidad para comprobarlo, ni esclarecer si el elemento en cuestión correspondía a una mezcla que implicaría la determinación incorrecta de un peso atómico de 40. William Crookes presentó algunas evidencias a favor de la corroboración del punto de ebullición y fusión del elemento argón, señalando la existencia de un único elemento en lugar de una mezcla. Henry Armstrong, un prestigiado químico, sostuvo que el argón podía comportarse como el nitrógeno que formaba una molécula diatómica inerte a pesar de que sus átomos individuales podían ser altamente reactivos[21].
Arthur William Rücker un físico argumentó que la incapacidad de mostrar un peso atómico aproximado podría ser correcta y que si este elemento no podía ser ubicado en la Tabla periódica, entonces la Tabla periódica en si misma carecía de legitimidad. Es así como 16 años posteriores a la publicación de la Tabla periódica de Mendeleev la validez de la Tabla periódica fue centro de enfrentamientos de índole académico.
Los resultados de la reunión de Royal Society encontrados eran un tanto inconclusos sobre el destino del argón como nuevo elemento, o si de hecho este podría ser validado como elemento. El mismo Mendeleev quien no estuvo presente en la reunión, publicó un artículo en la revista Londinense Nature en él concluyó el argón era de hecho triatómico y que correspondía a tres átomos de nitrógeno. Su conclusión fue basada al considerar el supuesto atómico de 40 que dividido por 3 daba aproximadamente 13.3 que correspondería con el peso atómico del nitrógeno[22].
La cuestión se resolvió finalmente en el años de 1900. En una conferencia de Berlín por Ramsey uno de los fieles codescubridores del nuevo gas, quién informó a Mendeleev de un nuevo grupo en el cual se agruparían elementos recientemente descubiertos helio, neón, criptón, y xenón, y que este podría ser elegantemente acomodado en una octava columna entre los halógenos y los metales alcalinos. Argón el primero de estos nuevos elementos representó un desafío de continua revisión por una inversión de pares. Poseía un peso atómico de 40 y sin embargo, aparece antes que el potasio con un peso atómico de 39. Mendeleev aceptó esta propuesta, respaldándola y escribió más adelante:
Esto era muy importante para él [Ramsey] como una afirmación de la posición de los elementos recientemente descubiertos y para él mismo como una gloriosa confirmación de la aplicabilidad general de la Ley periódica.
Lejos de amenazar la legitimidad de la Tabla periódica, el descubrimiento de los gases inertes y su establecimiento exitoso en la Tabla periódica permitió resaltar el gran poder y uniformidad del Sistema periódico de Mendeleev.
4.33 La física invade a Tabla Periódica
Aunque John Dalton había introducido la noción de átomos en la ciencia. Muchos debates prosiguieron entre químicos, en muchos de los cuales se negó a aceptar literalmente la existencia de los átomos. Uno de los químicos más escépticos fue Mendeleev, pero esto no le impidió la postulación y subsecuentes publicaciones mejoradas del Sistema periódico más exitoso de todos los tiempos. Siguiendo el trabajo de físicos como Einstein, la realidad del átomo se mostraba más firmemente establecida en inicios del siglo XX. Un documento de Einstein en 1905 sobre el movimiento browniano, usando métodos estadísticos proporcionó la justificación teórica concluyente de la existencia de los átomos, pero se continuaba careciendo de un soporte experimental. Este último fue proporcionado por el físico Jean Perrin.
Este cambio fue acompañado por muchas líneas de investigación para explorar la estructura del átomo, y es considerado uno de los acontecimientos de más importante influencia en los intentos de comprender teóricamente el Sistema periódico. De este modo la física del siglo XX con sus descubrimientos y continuas líneas de investigación contribuyó a lo que fue llamado invasión de la Tabla periódica por la física.
El descubrimiento del electrón, la primera partícula subatómica, y el primer indicio de que el átomo poseía una superestructura, vino en 1897 a manos del legendario J.J Thomson en el Laboratorio de Cavendish en Cambridge. Un poco antes en 1895, Wilhelm Konrad Röntgen había descubierto los rayos x en Würzburg, Alemania. Estos rayos pronto serían puestos en apropiado uso por Henry Moseley, un físico novel, primero en Manchester, y por el resto de su corta vida científica en Oxford.
Apenas un año después Röntgen había interpretado sus ImagLec3 de rayos X, Henri Becquerel en Paris descubrió un fenómeno de enorme importancia llamado radioactividad, por la que algunos átomos se fragmentaban espontáneamente mientras emitían un número diferente de nuevos tipos de rayos. Realmente se acuñó el término radioactividad a Marie Sklodowska (después Curie), quien desarrolló el trabajo de este peligroso nuevo fenómeno y pronto descubrió un par de nuevos elementos a los que llamó polonio y radio.
Estudiando cómo se fragmentaban los átomos mientras se experimentaba con el decaimiento radioactivo, hizo posible investigar los componentes del átomo con mayor eficacia, así como las leyes que gobiernan como átomos son transformados en otros átomos. Así que aunque la Tabla periódica se refiere a distintos átomos individuales o de diferentes elementos, parece haber algunas características particulares que permiten que algunos átomos se conviertan en otros bajo las condiciones adecuadas. Por ejemplo, la pérdida de una partícula alfa que consiste en un núcleo de helio con dos protones, resulta en una reducción del número atómico de un elemento por dos unidades.
Otro de los físicos influyentes en este tiempo, fue Ernest Rutherford, quién ingresó a Cambridge para asumir la dirección del Laboratorio Cavendish como sucesor Thomson. Las contribuciones de Rutherford a la física atómica fueron muchas y variadas e incluyeron el descubrimiento de las leyes que rigen la desintegración radiactiva, y presentarse como el primero en “dividir el átomo”. También fue el primero en lograr la transmutación de elementos en otros elementos nuevos. De esta forma Rutherford logró un análogo artificial por el proceso de radiactividad, produciendo átomos de un elemento completamente diferente y una vez más destacó la unidad esencial de todas las formas de la materia como había propuesto Mendeleev.
Otro de los descubrimientos de Rutherford consistió en el modelo nuclear del átomo, es decir la noción de que el átomo consiste en un núcleo central rodeado por electrones en orbitales de carga negativa. Su predecesor en Cambridge Thomson creía que el átomo consistía en una esfera de carga positiva dentro de la cual se encontraban los electrones distribuidos en forma de anillos.
Sin embargo, Rutherford no fue el primero en sugerir un modelo nuclear del átomo que se asemejó al de un sistema solar miniatura. Esta distinción perteneció al físico Jean Perrin quién en 1900 propuso que electrones negativos circulaban alrededor de un núcleo positivo como los planetas circulan alrededor del sol. En 1903 esta analogía astronómica dio un nuevo giro por Hantaro Nagaoka, que propuso su modelo de saturno en el que los electrones ahora tomaban lugar en los famosos anillos alrededor del planeta Saturno. Pero ninguno de estos modelos podía ser demostrado experimentalmente, como el propuesto por Rutherford.
Rutherford, junto con sus colaboradores Geiger y Marsden, disparó un rayo de partículas alfa a una delgada lámina de metal de oro, obteniendo un resultado sorprendente. Mientras que la mayoría de las partículas alfa pasaban a través de la lámina de oro de modo más o menos ininterrumpido, un número significativo de estas partículas se desviaban en ángulos muy oblicuos. La conclusión de Rutherford era que átomos de oro, o de cualquier elemento de la materia consistían principalmente en espacios vacíos a excepción de un núcleo central denso. El hecho de que algunas de las partículas alfa fueron inesperadamente rebotando hacia la corriente entrante de partículas alfa era así evidencia de la presencia de un pequeño núcleo central en cada uno de los átomos.
4.34 Rayos X
En 1895, el físico Röntgen hizo un descubrimiento trascendental, como más adelante escribiría el físico atómico Emilio Segré:
A principios de 1895 Röntgen había escrito cuarenta y ocho artículos hasta entonces prácticamente olvidados. Con su cuadragésimo noveno daba su golpe de oro.
Röntgen desarrolló un proceso de exploración de la acción de una corriente eléctrica en un tubo de cristal vacío, llamado tubo de Crookes. Röntgen notó un objeto que no era parte de su experimento, en el otro lado de su laboratorio este brillaba. Era una pantalla revestida de platinocianuro de bario, él interpretó rápidamente que la luz no era debida a la corriente eléctrica y que una nueva forma rayos se producía al interior del tubo de Crookes. Pronto Röntgen también descubrió la propiedad mejor conocida de los rayos X. Él encontró que podían reproducir una imagen de su mano que mostraba claramente los contornos aislados de sus huesos. Después de continuar experimentando secretamente por algunas semanas Röntgen estaba dispuesto a anunciar sus resultados a Würzburg Phyical-Medical Society, una coincidencia interesante dado a la diferenciación abismal en la investigación de estos dos campos.
Algunas de las ImagLec3 de rayos X de Röntgen se enviaron a Paris, donde llegaron a Henri Becquerel quien se interesó por examinar la relación entre los rayos X y la propiedad de fosforescencia, por la que ciertas sustancias emiten luz al exponerse al sol. Para probar esta idea Becquerel envolvió algunos cristales de una sal de uranio en un papel grueso y para evadir los rayos del sol, guardó estos materiales en un cajón por algunos días. Por un posible golpe de suerte Becquerel colocó sus cristales envueltos sobre una placa fotográfica sin desenrollar antes de cerrar el cajón. Unos días después finalmente al abrir el cajón, fue asombrado al encontrar una imagen creada en la placa fotográfica por los cristales a pesar de que la luz del sol no había incidido en ellos. Lo que sugiere que la propia sal de uranio fue emitiendo rayos, cualquiera que fuese el proceso de fosforescencia. Becquerel había descubierto la radioactividad, un proceso natural en algunos materiales, por el que el decaimiento radioactivo espontáneo de los átomos produce potentes y en algunos casos peligrosas emanaciones. Fue Marie Curie quien acuñó el término radioactividad unos años más tarde.
Sin encontrar la relación deseada entre los rayos X y la propiedad de fosforescencia de los elementos, el descubrimiento de la radioactividad de Becquerel correspondió a un temprano e importante paso en la exploración de la materia y la radiación y en un segundo término condujo indirectamente al desarrollo de las armas nucleares.
4.35 De vuelta a Rutherford
Alrededor del año 1911 Rutherford llegó a la conclusión de que la carga del núcleo equivalía aproximadamente a la mitad del peso de los átomos implicados Z≈A/2, después de analizar los experimentos de dispersión atómica. Conclusión que fue apoyada por el físico de Oxford Charles Barkla quién llegó a su interpretación por una vía completamente distinta, mediante la experimentación con rayos X.
Mientras tanto, Anton van den Broek pensaba sobre la posibilidad de modificar la tabla periódica de Mendeleev. En 1907, propuso una nueva Tabla periódica que contenía 120 elementos, aunque muchos de ellos permanecían como espacios vacíos. Algunos de estos vacíos fueron ocupados por algunas sustancias recién descubiertas cuyo estado elemental todavía estaba en cuestión. Incluían la emanación llamada torio, Uranio-X (un producto desconocido del decaimiento del uranio) y Gd2 (un producto de decaimiento del gadolinio) y muchas otras nuevas especies.
La propuesta más novedosa de van den Broek, fue la concepción de que todos los elementos están compuestos de una partide que llamó “alphon”, que consistía en la mitad de un átomo de helio con una masa de dos unidades de peso atómico. Pero en 1911 publicó en un artículo en el que abandonó esta concepción, conservando la idea de que los elementos difieren en dos unidades de peso atómico. En una carta dirigida a la revista Londinense Nature, dio un paso más hacia el concepto de número atómico, escribiendo.
… el número de elementos posibles es igual al número de cargas permanentes posibles…
Van den Broek sugirió esto basado en que la carga nuclear de un átomo era la mitad de su peso atómico, y que pesos atómicos de elementos sucesivos aumentaban acertadamente escalonados en dos unidades, la carga nuclear definiría la posición de un elemento en la Tabla periódica. En 1913 van den Broek escribió un libro que apareció en Nature, esta vez conectando explícitamente el número de atómico de cada átomo con la carga en cada átomo. Más importante tal vez, él había separado este número de serie respecto al peso atómico. Este documento histórico fue elogiado por muchos expertos en el campo incluyendo a Sody y Rutherford, quienes apreciaban la situación tan cercanamente como el mismo van den Broek.
4.36 Moseley
La persona que culminó, y a la que casi siempre se le da el crédito por el descubrimiento del número atómico fue el físico Henry Moseley. Su fama es basada en solo dos escritos en los que confirmó experimentalmente que el número atómico correspondía a un mejor principio de ordenamiento de los elementos que el peso atómico que no mostraba una continuidad estricta. Esta investigación también es importante porque permitió a otros científicos predecir cuantos elementos se encontraban aún a la espera de su descubrimiento entre los límites de los elementos que existen naturalmente entre el hidrogeno y el uranio[23].
Moseley recibió su formación en la Universidad de Manchester como alumno de Rutherford, los experimentos de Moseley consistieron en hacer reincidir luz en la superficie de las muestras de varios elementos, y registrar la frecuencia de rayos X característica emitida por cada uno de los elementos. Estas emisiones se producen porque un electrón interno es expulsado del átomo, causando que un electrón externo ocupe este espacio vacío, en un proceso que es acompañado de la emisión de rayos X.
Moseley en su primer escrito seleccionó 14 de los elementos, 9 del titanio al zinc que forman una secuencia continua de elementos en la tabla periódica. Lo que descubrió fue que la parcela de la frecuencia de rayos X emitida contra el cuadrado de un entero que representaba la posición de cada elemento en la tabla periódica (número atómico), genera un gráfico lineal. Allí residía la confirmación de la hipótesis de van den Broek de que los elementos pueden ser ordenados por medio de una secuencia de números enteros, más tarde reconociéndose como número atómico, un número entero para cada uno de los elementos comenzando con H=1, He=2 y así sucesivamente.
En su segundo escrito, extendió esta relación a otros 30 de los elementos, concertando así el estado de sofisticación en su concepción del número atómico. Entonces se convirtió en una cuestión relativamente simple para Moseley corroborar si las predicciones recientemente afirmadas por múltiples autores sobre los elementos eran legítimas o no. Por ejemplo, el químico Seiji Ogawa había afirmado el aislamiento de un elemento que permitiría rellenar el espacio vacío debajo del manganeso en la Tabla periódica. Moseley midió la frecuencia de rayos X de la muestra descrita por Ogawa encontrando una frecuencia que no correspondía con el valor esperado para el elemento 43. Los experimentos de Moseley permitieron demostrar una secuencia perfectamente regular en el ordenamiento de los elementos en la Tabla periódica, adoptando una unidad, el número atómico.
Después de la temprana muerte de Moseley en la primera guerra mundial, otros químicos y físicos emplearon su método y encontraron las incógnitas que permanecían correspondientes a los números atómicos 43, 61, 72, 75, 85, 87 y 91 entre la secuencia uniformemente espaciada de números atómicos. No fue hasta 1945 cuando se ocupó el último de estos espacios vacíos, siguiendo la síntesis del elemento número 61, prometio.
4.37 Isótopos
El descubrimiento de los isótopos de cualquier elemento particular es otro de los pasos claves en la comprensión de la Tabla periódica que se produjo en los albores de la física atómica. El término proviene del Iso (igual) y topos (lugar) y se emplea para describir las especies atómicas de cualquier elemento en particular que difieren en peso y sin embargo, ocupan el mismo lugar en la Tabla periódica. Este descubrimiento surgió en parte como una cuestión de necesidad. Los desarrollos innovadores en la física atómica condujeron al descubrimiento de una serie de nuevos elementos tales como el Ra, Po, Rn y Ac que fácilmente asumen su lugar legítimo en la Tabla periódica. Pero aunados a estos aparecieron 30 o más nuevos elementos evidentes que fueron descubiertos en un periodo relativamente corto de tiempo. Estas nuevas especies fueron nombradas provisionalmente como emanación del torio, emanación del radio, actinio X, Uranio X, Torio X y así sucesivamente para indicar el decaimiento de los elementos de los que procedían. El Xs denota especies desconocidas, que resultaron ser isótopos de diferentes elementos en la mayoría de los casos. Por ejemplo, uranio X fue reconocido más adelante como isótopo del torio[24].
Algunos diseñadores de Tablas periódicas, como van den Broek intentaron dar cabida a estos nuevos elementos en Tablas periódicas ampliadas. Mientras tanto, Daniel Strömholm y Theodor Svedberg producían Tablas periódicas en las que algunas de estas nuevas especies exóticas fueron forzadas a permanecer en el mismo lugar. Por ejemplo, a continuación del gas noble xenón colocaron la emanación del radio, emanación de actinio y emanación del torio. Esto parece representar una anticipación de isotopía, pero no un claro reconocimiento del fenómeno. En 1907, Herbert McCoy concluyó que el radio-torio era totalmente inseparable del torio por procesos químicos. Esta fue una observación clave que pronto fue repetida en el caso de muchos otros pares de sustancias que originalmente habían sido pensadas como nuevos elementos. El pleno reconocimiento de estas observaciones fue hecho por Frederick Soddy y otro de los que fuesen alumnos de Rutherford.
Para Soddy, la inseparabilidad química significaba una sola cosa, dos formas distintas de un único elemento químico particular. En 1913, acuñó el término “isótopos” para referir a dos o más átomos del mismo elemento que se presentaban como químicamente inseparables. La inseparabilidad química también fue observada por Friedich Paneth y Georg von Hevesy en el caso de la relación del plomo y radio-plomo después de que ha petición de Rutherford se intentara separarlos químicamente. Después de esta hazaña por 20 diferentes enfoques químicos, se vieron obligados a admitir el fracaso completo en el descubrimiento de nuevos elementos. Un fracaso en algunos aspectos pero que solidificó aún más la noción de un elemento, en este caso, el plomo con isótopos químicamente inseparables.
Los esfuerzos de Penth y von Hevesy les permitieron establecer una nueva técnica para el etiquetado radioactivo de las moléculas, que se convirtieron en la base para una subdisciplina bondadosa con aplicaciones de largo alcance en áreas como la investigación médica y bioquímica.
En 1914, la isotopía ganó incluso un mayor apoyo por la obra de T. W. Richards en Harvard, que establecía los pesos atómicos de dos de los isótopos medidos en un mismo elemento. Eligiendo al plomo por proceder de una serie de decaimiento radioactivo que originado por esta vía implicaba elementos intermedios muy diferentes que se presentaban en formas atómicas diferentes que podían diferir hasta en 0.85 unidades de peso atómico.
Finalmente el descubrimiento de los isótopos clarificó aún más la aparición de inversiones de elementos emparejados, como el caso del telurio y yodo en la representación de Mendeleev. El telurio tiene un peso atómico mayor que el yodo, aunque lo antecede en la Tabla periódica, porque la media ponderada de todos los isótopos del telurio posee valores más altos que la media ponderada de los isótopos del yodo. Desde esta perspectiva, el peso atómico es visto como una cantidad contingente dependiendo de la abundancia relativa de todos los isótopos de un elemento. La cantidad más fundamental, como ahora la Tabla periódica refiere, es el número atómico de van den Broeck-Moseley, que más tarde fue conciliado, el número de protones en el núcleo. La identidad de un elemento es capturada por su número atómico y no por su peso atómico, pues este difiere según la muestra particular del elemento que ha sido aislado.
4.38 Estructura electrónica
El direccionamiento del Sistema periódico acompañado de los descubrimientos de la física clásica permitieron las demostraciones experimentales dirigidas a la valoración del núcleo de los elementos para el ordenamiento último por su número atómico, pero permanecía la incertidumbre sobre algunas de las propiedades de los elementos individuales y su comportamiento químico, cuyo esclarecimiento fue de la mano de la aparición de la teoría cuántica desde su concepción.
El reconocimiento de los elementos se había restringido a los procesos que tienen lugar en el núcleo del átomo. La radioactividad esencialmente representaba la desintegración del núcleo, y la transmutación de los elementos. El número atómico era una propiedad intrínseca de los núcleos de los átomos, mientras los isótopos se distinguían por las diversas masas de los átomos de un mismo elemento, que están formadas casi exclusivamente por las masas de sus núcleos. La física cuántica brindaría los medios para una comprensión más sofisticada de los átomos y sus partículas subatómicas.
Todo comenzó antes de la vuelta del siglo XX en Alemania, donde un número considerable de físicos se esforzaban por comprender el comportamiento de la radiación llevada a cabo en una pequeña cavidad de paredes ennegrecidas. El comportamiento espectral de la llamada “radiación del cuerpo negro” se registró cuidadosamente a diferentes temperaturas y luego se trataron de modelar matemáticamente los gráficos resultantes. El problema continuaría sin resolverse por mucho tiempo hasta que Max Planck hizo la audaz suposición de que la energía de esta radiación consistía en paquetes discretos o “cuantos” en el año de 1900. Planck parece haber sido reacio a aceptar el significado pleno de su nueva teoría cuántica, permitiendo a los demás hacer algunas nuevas aplicaciones de la misma.
La teoría cuántica afirma que la energía viene determinada en paquetes discretos y que no hay valores intermedios que puedan aparecer entre ciertos números enteros múltiplos de la cuantía básica de energía. Esta teoría fue aplicada con éxito al efecto fotoeléctrico en 1905 por Albert Einstein, probablemente el físico más brillante del siglo XX. El resultado de su investigación fue que la luz podía ser considerada como quantums o partículas. Sin embargo, Einstein pronto comenzó a considerar a la mecánica cuántica como una teoría incompleta y que le valdría como centro de crítica por el resto de su vida.
En 1913, Niels Bohr aplicó la teoría cuántica al átomo de hidrógeno, quién suponía como Rutherford que el átomo consistía en un núcleo central con electrones circulando alrededor de este. Bohr supuso que la energía disponible para el electrón ocurría solamente en valores discretos, o en términos pictóricos que el electrón podía existir en cualquier número de capas u orbitales alrededor del núcleo. Este modelo podría explicar hasta cierto punto, un par de características del comportamiento del átomo de hidrógeno, y de hecho de los átomos de cualquier elemento. En primer lugar explicó porque los átomos de hidrógeno que fueron expuestos a una ráfaga de energía eléctrica resultaban en un espectro discontinuo en el que algunas frecuencias bastante específicas, serían observadas. Bohr interpretó que este comportamiento surgió cuando un electrón experimentó una transición de un nivel de energía permitido a otro. Esta transición se acompañaba por la liberación o absorción de la energía precisa correspondiente a la diferencia de energía entre los dos niveles de energía u orbitales del átomo.
En segundo lugar, y menos satisfactoriamente, el modelo explicó porque los electrones no pierden su energía y se estrellan en el núcleo de cualquier átomo, como se predijo al aplicar la mecánica clásica a una partícula con carga en movimiento circular. La respuesta de Bohr era que los electrones simplemente no perderían energía siempre que permanecieran en sus orbitales fijos. Él también postuló que había un nivel de energía menor más allá del cual, el electrón no podría pasar a una transición más bajo de energía, un orbital atómico inferior.
Bohr entonces, amplió su modelo para cubrir cualquier átomo de un número mayor de electrones en lugar de limitarse al átomo de hidrógeno. Él también mostró gran interés en establecer la forma en que los electrones estaban distribuidos en cualquier átomo particular. Mientras que la validez teórica del salto de un electrón a la implicación de muchos electrones dispuestos en diferentes orbitales no impidió a Bohr hacer una interpretación brillante desarrollando las configuraciones electrónicas de los elementos.
Pero la asignación de Bohr de los electrones en capas no se llevó a cabo por motivos matemáticos, ni con la ayuda explícita de la teoría cuántica. Por el contrario, Bohr hizo referencia a indicios químicos como el conocimiento de que los átomos del elemento boro pueden formar tres enlaces, como los otros elementos que lo acompañan en su grupo en la Tabla periódica. Por lo tanto, un átomo de boro debe poseer tres electrones en su orbital más externo para que el proceso sea posible. Pero incluso con una teoría rudimentaria y no deductiva, Bohr postuló la primera explicación exitosa basada en la configuración electrónica de porque los elementos litio, sodio, y potasio se encontraban en el mismo grupo en la Tabla periódica y además esta explicación era aplicable para los miembros de cualquier grupo de la Tabla periódica. En el caso del litio, sodio y potasio, era porque en cada uno de sus átomos se encontraba un electrón diferenciado de los electrones restantes, en un orbital más externo[25].
La teoría de Bohr tenía algunas limitaciones, una de ellas es que solo era estrictamente aplicable a un electrón en el orbital más externo como en el átomo de hidrógeno, y la forma de iones de He+, Li+2, Be+3, etc. También se encontró que algunas de las líneas del espectro en las ImagLec3 espectrales del hidrógeno como ion se disolvían en inesperados pares de líneas. Arnold Sommerfeld sugirió que el núcleo podría posicionarse en uno de los extremos de la elipse en lugar de en el corazón de un átomo circular. Sus cálculos demostraron que había que introducir subcapas dentro de las capas principales de Bohr de los electrones. Considerando que el modelo de Bohr fue caracterizado por un número cuántico que denotaba cada una de las capas separadas u orbitales, el modelo modificado por Sommerfeld requería de dos números cuánticos para especificar el orbital elíptico del electrón. Disponiendo de estos nuevos números cuánticos Bohr compiló un conjunto más detallado de las configuraciones electrónicas en 1923.
Años más tarde el físico Edmund Stoner encontró un tercer número cuántico que resultaba necesario para especificar algunos detalles del espectro de hidrógeno y otros átomos. En 1924 el teórico Wolfgang Pauli descubrió la necesidad de un cuarto número cuántico que fue identificado mediante el concepto de que el electrón adopta uno de los dos valores posicionales posibles en un tipo especial de ímpetu angular. Este tipo de movimiento eventualmente fue llamado “spin” del electrón aunque los electrones no giran literalmente en los orbitales atómicos de la misma manera que la tierra gira sobre un eje mientras también realiza un movimiento traslacional orbitando alrededor del sol.
Los cuatro números cuánticos están relacionados entre sí por un conjunto de relaciones anidadas. El tercer número cuántico depende del valor del segundo número cuántico que a su vez depende del primer número cuántico. El cuarto número cuántico de Pauli es un poco diferente ya que puede adoptar los valores de +1/2 o -1/2 independientemente de los valores de los otros números cuánticos. La importancia del cuarto número cuántico, fue la de proporcionar una apropiada explicación de porqué cada orbital electrónico puede contener un número delimitado de electrones (2, 8, 18, 32, etc.) comenzando con el orbital más cercano al núcleo.
El primer número cuántico N puede adoptar cualquier valor integral partiendo del 1. El segundo número cuántico, mostrado como l puede tener cualquiera de los valores siguientes determinados por el valor de n.
l=n-1, 0……
Para un caso de n=3, por ejemplo l puede tomar los valores de 2, 1, o 0. El tercer número cuántico puede adoptar valores determinados por el valor del segundo en los números cuánticos, como;
m l = -l, -(l +1),…0…(l -1), l
Por ejemplo si l =2, la posibilidad para los valores de m l son
-2, -1, o, +1, +2
Finalmente el cuarto número cuántico representado como ms solo puede adoptar dos valores posibles, ya sea +1/2 o -1/2 unidades spin del momento angular. Por lo tanto, se crea una jerarquía de valores relacionados entre los cuatro números cuánticos, que describen cualquier electrón particular en un átomo.
Como resultado de este esquema, es evidente que un tercer orbital atómico puede contener un total de 18 electrones. Sí el primer número cuántico, dado por el número del orbital es 3, habrá un total de 2 × (3)2 o 18 electrones en el tercer orbital. El segundo número cuántico l puede tomar valores de 2, 1 o 0. Cada uno de estos valores generará un número de posibles valores de m l y cada uno de estos valores se multiplicarán por un factor de dos, el cuarto numero cuántico puede adoptar dos valores posibles +1/2 o -1/2.
Pero el hecho de que el tercer orbital pueda albergar 18 electrones no estrictamente explica porque algunos de los periodos del Sistema periódico contienen 18 lugares. La explicación rigurosa de la ocupación de los orbitales por los electrones residió en que estos fueron llenados en estricto orden secuencial. Aunque los orbitales electrónicos fueran llenados de forma secuencial, esto perdía credibilidad a partir del elemento número 19, el potasio. Las configuraciones electrónicas se construyen comenzando con orbital 1s que pueden contener dos electrones, pasando al orbital 2s que de la misma manera se ocupa por dos electrones. Luego aparecen los orbitales 2p que en conjunto contienen seis electrones y así sucesivamente. El proceso continúa de manera predecible hasta el elemento número 18 o argón cuya configuración electrónica es.
1s2, 2s2, 2p6, 3s2, 3p6
Podría esperarse que la configuración electrónica del elemento posterior, número 19 o potasio fuese.
1s2, 2s2, 2p6, 3s2, 3p6, 3d1
Donde el electrón final ocupa el orbital siguiente representado como 3d. Esto se espera porque hasta este punto el principio rector ha sido el acomodo del electrón diferenciador entre un elemento y otro en el orbital disponible más cercano al último orbital ocupado aumentando la distancia respecto al núcleo. Sin embargo la evidencia experimental muestra que la configuración debe ser denotada como se muestra a continuación.
1s2, 2s2, 2p6, 3s2, 3p6, 4s1
De manera similar, en el caso del elemento número 20, el calcio el nuevo electrón es integrado a un orbital 4s. Pero en el siguiente elemento, el número 21 o escandio la configuración electrónica muestra un orbital que nuevamente escapa a la secuencia establecida.
1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d1
Este tipo de saltos hacia delante y hacia atrás entre los orbitales disponibles en él cómo los electrones ocupan estos en elementos sucesivos se repite una y otra vez. El orden de llenado se resume como.
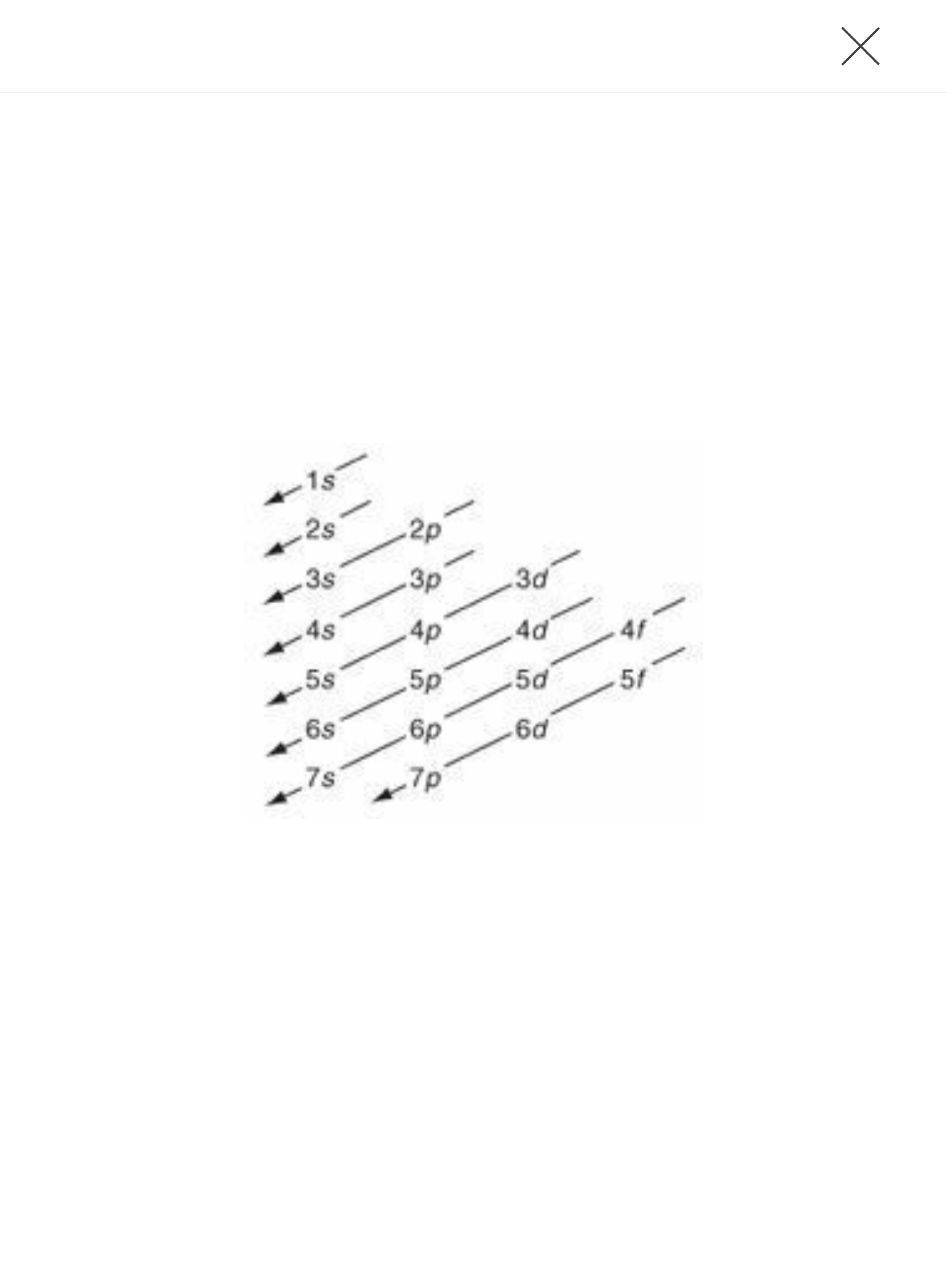
4.39 Orden de llenado de orbitales atómicos
Siguiendo las flechas diagonales de arriba hacia abajo. Como consecuencia de este orden de llenado, sucesivos periodos en la Tabla periódica contienen el siguiente número de electrones en los elementos 2, 8, 8, 18, 18, 32, etc. Mostrando así una duplicación en cada periodo excepto en el primero.
Mientras que la regla para la combinación de cuatro números cuánticos proporciona una explicación rigurosa desde el punto de orbitales cercanos, no proporciona una explicación igualmente rigurosa para el punto de orbitales de cierre, cuando los átomos de los elementos integran 8 electrones en los orbitales más externos ( 2 para el He), lo que les confiere gran estabilidad al presentarse como inertes a las interacciones con otros átomos. Los intentos de defender este orden de llenado solían estar unidos a la interpretación y lo que pretendía ser explicado. Sabemos que los periodos se cierran porque los gases nobles producen elementos con disposición de electrones de la forma 2, 10, 18, 36, 54, etc. Del mismo modo se tenía conocimiento del orden de llenado de orbitales acorde las observaciones pero no englobado en una teoría estructurada. La conclusión más elaborada de interpretación por su escasa citación en los libros de texto referentes a la Tabla periódica, es que la física cuántica explica solo en parte la Tabla periódica. Nadie había deducido el orden de los orbitales intermedios de relleno desde los principios de la mecánica cuántica. Lo que de ninguna manera significa que el orden de llenado de los orbitales atómicos por los electrones es en algún sentido intrínsecamente irreductible a la física cuántica.
Químicos y configuraciones
El descubrimiento del electrón por Thomson en 1897 abrió paso a todo tipo de explicaciones en física así como totalmente nuevas líneas de experimentación. Thomson fue también uno de los primeros en discutir la manera en que se organizan los electrones en los átomos, aunque su teoría no alcanzara el éxito esperado en parte porque se desconocía cuantos electrones existían en un átomo particular.
La primera teoría importante de este tipo fue propuesta por Bohr quién introdujo también el concepto de cuantización de la energía en el reino del átomo y en la asignación de los arreglos electrónicos. Bohr tuvo éxito en la publicación de un conjunto de configuraciones electrónicas para muchos de los átomos de los elementos conocidos, pero fue solo después de consultar el comportamiento espectral y químico que había sido reunido por otros durante muchos años.
¿Pero que hacían los químicos en este tiempo? ¿cómo se compararon sus intentos de explotar la naturaleza electrón, los de Bohr con otros físicos cuánticos? Este aborde inicia posterior al descubrimiento del electrón, en 1902. El químico G. N. Lewis bosquejó un diagrama del que la copia original existe a este día. En él asumió que los electrones se producen en las esquinas de un cubo y que a medida que se avanza a través de la tabla periódica, un elemento a la vez, se agrega un electrón más en una de las esquinas. La elección de un cubo puede parecer algo extraño desde una perspectiva moderna ya que ahora sabemos que los electrones circulan alrededor del núcleo. Pero el modelo de Lewis tiene sentido en un aspecto importante íntimamente relacionado con la Tabla periódica. Ocho es el número de elementos a través de los cuales debe avanzarse antes de que ocurra una repetición en las propiedades de los elementos.

4.40 Dibujos de Lewis de los cubos atómicos
Entre dos átomos
Lewis por lo tanto fue quién sugirió que la periodicidad química y las propiedades individuales de los elementos se regían por el número de electrones en el cubo exterior disponiendo los electrones alrededor del núcleo del átomo. La principal falla del modelo es presentar a los electrones como partículas fijas, pero la elección del cubo es una concepción ingeniosa y natural, que refleja el hecho de que la periodicidad química se basa en intervalos de ocho elementos.
En el mismo famoso bosquejo, Lewis dio un diagrama de cómo átomos de sodio y cloro pueden formar un compuesto, después de que un electrón se transfiere de un átomo de sodio a un átomo de cloro, en el orden de ocupar el espacio del octavo electrón que faltaba en el cubo más externo entorno al cloro. Pero Lewis esperó 16 años para hacer públicas estas interpretaciones, así como ampliarlas al incluir otra forma de vinculación, el enlace covalente, que consiste en el intercambio en lugar de la transferencia de electrones entre átomos diferentes.
Teniendo en cuenta muchos de los compuestos conocidos y contando el número de electrones externos que poseían en sus átomos, Lewis llegó a la conclusión de que en la mayoría de los casos el conteo de los electrones generaba un número par. Este hecho sugirió para él que los enlaces químicos podían deberse al apareamiento de electrones, una idea que pronto se convirtió en central en toda la química y que sigue siendo esencialmente correcta, incluso en la evaluación de la teoría de la mecánica cuántica desde la vinculación química.
Para representar la distribución de los electrones entre dos átomos, Lewis dibujó dos cubos adyacentes que compartían un borde, o dos electrones. Del mismo modo, un doble enlace estuvo representado por dos cubos que comparten una cara común o cuatro electrones.
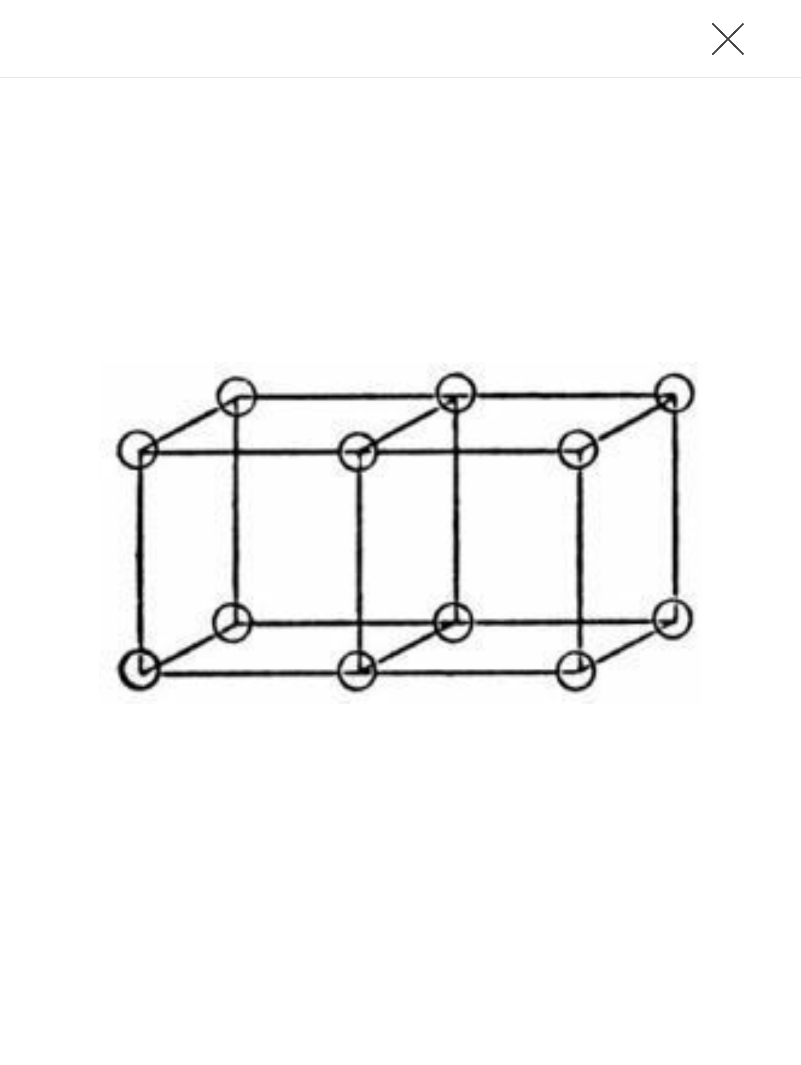
4.41 Representación de Lewis de un doble enlace entre dos átomos.
Pero entonces surgió un problema. En química orgánica se tiene conocimiento de algunos compuestos, como el acetileno C2H2 que contiene un enlace triple. Lewis se dio cuenta de un cubo que disponía los electrones en sus esquinas no podía representar enlaces triples. En el mismo escrito, desarrolló un nuevo modelo en el que cuatro pares de electrones fueron situados en las esquinas de un tetraedro en lugar de un cubo. Un enlace triple sería entonces representado por dos tetraedros que comparten una cara común.
En este modelo de dos tetraedros, Lewis volvió a la cuestión de las configuraciones electrónicas de los átomos y en ese momento decidió extender sus arreglos a 29 de los elementos. G. N. Lewis es posiblemente el químico más importante del siglo XX que no recibió un Premio Nobel esto presumiblemente por su muerte temprana en su propio laboratorio por una intoxicación de cianuro de hidrógeno y el hecho de que los Premios Nobel no son otorgados póstumamente.
Las ideas de Lewis fueron extendidas y popularizadas por el químico Irving Langmuir. Quien se dispuso a completar las configuraciones electrónicas de los elementos, ya que Lewis solo completó las de 29 átomos. Mientras que Lewis se había abstenido de asignar configuraciones electrónicas a los átomos de los elementos metálicos de transición, Langmuir presentó la siguiente lista en 1919.
Se |
Ti |
V |
Cr |
Mn |
Fe |
Co |
Ni |
Cu |
Zn |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
Como lo había postulado Lewis, Langmuir empleó las propiedades químicas de los elementos como principio rector y no las argumentaciones de la teoría cuántica. En 1921, el químico Charles Bury trabajando en University Collegue of Wales en Abrystwith, desafió una idea que se encontraba implícita en los trabajos de Lewis y Langmuir. El suponer que los orbitales de los electrones son llenados secuencialmente al moverse a través de la Tabla periódica, añadiendo un electrón adicional para cada nuevo elemento, Bury afirmó que su sofisticado conjunto de configuraciones electrónicas proporcionaba una mejor conciliación con los hechos químicos conocidos.
Ya que ocho es el número máximo de electrones en una capa externa en los elementos K, Ca, y Sc debe formarse una cuarta capa a pesar de que su tercera capa no esté completa. Sus estructuras electrónicas serán 2, 8, 8, 1; 2, 8, 8, 2; 2, 8, 8, 3.
Bury también rompió con Lewis y Langmuir, sugiriendo que podían cambiar los grupos internos y aparentemente estables de 8 electrones en grupos de 18 electrones y del mismo modo que los grupos de 18 electrones podían cambiar a grupos de 32. Estas características representan algunos indicios de la aparición del formato medio largo de la Tabla periódica respectivamente.
Los físicos proporcionaron un gran impulso a los intentos de comprender la base subyacente de la Tabla periódica pero los químicos de la época fueron en muchos casos capaces de aplicación de las nuevas ideas de la física, como las configuraciones electrónicas, para un mejor efecto.
4.42 Mecánica cuántica
El principio de exclusión de Pauling permitió la comprensión de por qué cada orbital alrededor del átomo podía contener un determinado número de electrones (primer capa 2-, segunda capa -8, tercer capa -18, etc.). Si se asume como el orden correcto de llenado de los orbitales dentro de estas capas, podría explicarse el hecho de que los periodos eran en realidad, 2, 8, 8, 18, 18, etc. Pero cualquier explicación digna de la Tabla periódica debe ser capaz de derivar en esta secuencia de valores provenientes de principios básicos, sin asumir el orden observado en el llenado de los orbitales.
La teoría cuántica de Bohr, incluso aumentada por las contribuciones de Pauli, por lo tanto era solo un paso hacia una teoría más avanzada. La versión de Bohr Pauli es llamada generalmente teoría cuántica o en ocasiones la antigua teoría del quántum para distinguirse del posterior desarrollo que tendría lugar en 1925 y 1926 que es reconocida como mecánica cuántica. El uso de la palabra teoría para denotar la antigua versión es un poco lamentable porque refuerza la falsa idea de que una teoría es algo vago que en su camino puede convertirse en una ley científica o alguna otra pieza más sólida de conocimiento.
Pero en ciencia, una teoría es un gran apoyo, aunque no haya sido demostrada, es un cuerpo de conocimientos, en el cual nada posee un estado más elevado que las leyes científicas. Muchas leyes diferentes a menudo son incluidas dentro de una teoría global. Por lo que la mecánica cuántica, la teoría sucesora, era cada pedacito de una “teoría” como la antigua teoría del quántum de Bohr, aunque esta era más sofisticada y de un notable éxito distinguible.
La antigua teoría del quántum de Bohr tenía varias deficiencias incluyendo el hecho de que no podía explicar la vinculación química de los elementos, pero todo esto cambió tras el advenimiento de la mecánica cuántica. Entonces llegó a ser posible ir más allá de la idea picaresca de G, N Lewis donde la vinculación resultaba de un último intercambio de electrones entre dos o más átomos en una molécula. Según la mecánica cuántica, los electrones se comportan tanto como ondas y como partículas. Escribiendo una ecuación de onda para el movimiento de los electrones alrededor del núcleo, Erwin Schrödinger fue capaz de dar un paso trascendental. Las soluciones de la ecuación de Schrödinger, que son muchas, representan los posibles estados cuánticos en que los electrones en un átomo pueden ser encontrados. Un poco más adelante dos físicos, Hund y Mulliken, desarrollaron independientemente la teoría del orbital molecular en la que la vinculación de los elementos fue encontrada como un suceso resultado de la interferencia constructiva y destructiva entre las ondas de los electrones en cada átomo en una molécula.
Pero tenemos que volver a los átomos y a la Tabla periódica. Empleando la teoría de Bohr solo los átomos cuyos niveles de energía podrían ser calculados serían los que integraran en un electrón en su orbital más externo, que incluye al átomo de hidrógeno y un electrón de iones como He+1, Li+2, Be+3, etc. En el caso de átomos con un número considerable de electrones, donde se encontraban muchos de los elementos, la teoría antigua del quántum de Bohr permanecía impotente. Por el contrario, usando la nueva mecánica cuántica átomos de muchos electrones podrían ser manejados por los teóricos, aunque es cierto que de una manera aproximada en lugar de un aborde exacto. Esto es debido a una limitación matemática, cualquier sistema con más de un electrón consiste en un llamado “problema de muchos cuerpos” y este tipo de problemas solo admiten soluciones aproximadas.
Así que las energías de los estados cuánticos para cualquier átomo de muchos electrones pueden calcularse aproximadamente desde sus principios básicos, aunque no existe un acuerdo ideal con los valores observados de la energía. Sin embargo, algunos aspectos globales de la Tabla periódica aún no han sido derivados desde su sus inicios hasta nuestros días. Por ejemplo, el orden de llenado de los orbitales atómicos.
Los orbitales atómicos que conforman capas y subcapas en cualquier átomo se llenan en orden creciente de los valores de la suma de sus dos primeros números cuánticos que denotan cualquier orbital particular. Este hecho se resume por n + l o regla de Madelug. Los orbitales son llenados de tal modo que el valor de n + l se incrementa gradualmente, a partir del valor uno para el orbital 1s. Siguiendo las flechas diagonales comenzando del orbital 1s y luego trasladándose en diagonal al siguiente conjunto de líneas se obtiene el orden de llenado del orbital, que se presenta como sigue.
1s<2s<3s<3p<4s<3d<4p<5s etc.
A pesar de muchos éxitos deslumbrantes, la mecánica cuántica aún no ha logrado derivar esta secuencia n + l valorándose de manera puramente teórica. Esto no disminuye los éxitos de la reciente teoría que son verdaderamente impresionantes. Es justo señalar que persiste una característica que aún debe ser aclarada. Tal vez un físico cuántico pueda tener éxito en derivar la regla de Madelug en el futuro, o tal vez necesite una teoría futura aún más sofisticada para hacerlo, y esto no significa la irreductibilidad de los fenómenos químicos a la física cuántica, pero más precisamente podría corresponder al soporte en la Tabla periódica.
La mecánica cuántica ha iluminado el fenómeno de periodicidad química de los elementos. La ecuación de Schrödinger puede ser escrita y resuelta para cualquier sistema de un átomo en la Tabla periódica sin ningún aborde experimental. Por ejemplo, físicos y químicos teóricos han logrado calcular las energías de ionización de los átomos en la tabla periódica. Cuando estos cálculos se compararon con los valores experimentales se encontró un notable grado de acuerdo. La energía de ionización es una de las muchas propiedades de los átomos que presentan una periodicidad química marcada. Como el aumento del número atómico iniciando como Z=1 para el hidrógeno, la energía de ionización muestra un incremento significativo al alcanzar el elemento siguiente, helio. Esto es seguido por una disminución aguda antes de alcanzar Z=3 o litio. Los valores subsecuentes de energía de ionización se encuentran entonces en aumento, en términos generales hasta llegar a un elemento químicamente similar al helio, el neón otro de los gases nobles. Este patrón de aumento global de la anergía de ionización, luego se repite en todos los periodos de la Tabla periódica. Y para cada periodo el valor mínimo de la energía de ionización reside en los elementos del grupo 1 como el litio, sodio y potasio. Los valores máximos recaen en los gases nobles como el helio, neón, argón, criptón y xenón. Al graficar los valores calculados teóricamente se muestra una curva con un patrón de relación para los gases nobles respecto su grupo de elementos en la Tabla periódica.
La conclusión es que aunque la mecánica cuántica no ha logrado aún producir una derivación general de la ecuación de Schrödinger para el orden de llenado de los orbitales atómicos (regla n + l ), se ha explicado exitosamente la periodicidad de las propiedades de los átomos de todos los elementos. Esta determinación se lleva a cabo sobre la base uno para cada átomo separado y no a través de una solución universal de uno aplicable a todos los átomos de los elementos.
Muchos de los fenómenos en la Física se presentan en forma de ondas. La luz se propaga como ondas de luz y el sonido como ondas sonoras. Cuando una roca es arrojada a un estanque, una serie de ondulaciones u ondas de agua comienzan a irradiar desde el punto en que la roca ha penetrado en el agua. Dos interesantes fenómenos están asociados con las ondas de estas tres clases o de hecho con las ondas de cualquier tipo. En primer lugar las ondas muestran un efecto llamado difracción que describe la manera en que las ondas tienden a propagarse cuando pasan a través de una abertura o alrededor de cualquier obstáculo.
Además, cuando dos o más ondas arriban a una pantalla juntas se dicen “en fase” produciendo un efecto llamado interferencia constructiva que lleva a un aumento general en la intensidad por encima de las intensidades de dos o más ondas separadas. Por el contrario, dos ondas arriban a una pantalla con una salida de fase distinta, generan una interferencia destructiva, el resultado es una cancelación de la intensidad de las ondas. A principios de 1920 por razones un tanto inciertas, se sospechaba que partículas como los electrones podían comportarse como ondas bajo determinadas condiciones. Exponer brevemente esta idea correspondió a una inversión lógica del trabajo de Einstein sobre el efecto fotoeléctrico, en el que se había establecido que las ondas de luz también se comportan como partículas.
Con el fin de comprobar si las partículas tales como los electrones poseían un comportamiento como ondas, era necesario ver si los electrones también eran capaces de producir efectos de difracción e interferencia como todas las clases de ondas son capaces. Sorprendentemente como puede parecer estos experimentos fueron exitosos y la naturaleza de onda de los electrones fue establecida de una vez por todas. Además encontraron que un haz de electrones dirigidos a un único cristal de níquel producía una serie de anillos concéntricos, es decir un patrón de difracción fue formado, debido a la separación de las ondas de los electrones alrededor del cristal en lugar de rebotar sobre él.
De este punto en adelante, electrones y otras partículas fundamentales, debían considerarse con una especie de naturaleza esquizofrénica como partículas y como ondas. Más concretamente la noticia de que las partículas se comportaban como ondas llegó a la comunidad de físicos teóricos y al mismo Erwin Schrödinger que había estudiado con profundidad el comportamiento del electrón en un átomo de hidrógeno en un intento de modelar las ondas. Sus concepciones eran primero que los electrones se comportaban como ondas y segundo que la energía potencial del electrón consistía en la energía por la cual era atraído por el núcleo. Schrödinger resolvió su ecuación haciendo que los físicos matemáticos continuaran tratando de resolver ecuaciones diferenciales de este tipo aplicando condiciones particulares.
Consideremos una cuerda de guitarra limitada en tanto termina, lo que llamamos tuercas y el puente respectivamente, al pulsar la cuerda se juega una secuencia abierta. Se hará vibrar la cuerda en un movimiento hacia arriba y abajo en la forma de la mitad de una onda completa. ¿Pero cómo puede vibrar la cuerda? La respuesta es que puede vibrar como dos medias longitudes de onda (en suma una longitud de onda entera). El sonido producido es descrito por los músicos como armónico, siendo significativamente agradable. Los modos adicionales en que la cuerda puede vibrar consisten en 3, 4, 5, ondas medias…, la cuerda solo puede vibrar como un número entero de ondas medias.
En términos matemáticos así como en términos físicos lo que ocurre es que al imponer condiciones límite (los dos puntos fijos en una guitarra real), ha dado como resultado un conjunto de movimientos que se caracterizan por corresponder a números enteros. Esto asciende a nada menos que la cuantificación o la restricción de un valor a números enteros múltiplos. Por analogía cuando Schrödinger aplicó estas condiciones en los límites matemáticos de su ecuación, las energías que calculó para el electrón resultaron ser cuantizables, algo que en las ecuaciones de Bohr había sido obligado a pasar implícito. En el caso de Schrödinger, existió una mejora sustancial en la que consiguió la cuantización de la energía en lugar de introducirla artificialmente, surgiendo como un aspecto natural de la teoría.
El físico Werner Heisenberg encontró una relación muy sencilla que se presenta a continuación, esta mostraba la incertidumbre de la posición de una partícula multiplicada por la incertidumbre de su impulso.
Esta ecuación implica que debe abandonarse la noción del sentido común de que una partícula como el electrón tiene simultáneamente una posición bien definida y un momentum (impulso), es como si el movimiento de las partículas tuviera una naturaleza confusa o incierta, lo que en términos de la mecánica cuántica significaba que ya no podían considerarse a los orbitales como espacios definidos para los electrones. En cambio la teoría reabordaba el hablar en términos de probabilidades (incertidumbre) en lugar de certezas. En la mecánica cuántica, el electrón se considera extendido a lo largo de una capa esférica. Es como si la partícula familiar se hubiera convertido en un gas que se extiende para llenar todo el contenido de una esfera que corresponde exactamente a una versión tridimensional de la órbita bidimensional de Bohr. Además la esfera de carga de la mecánica cuántica no tiene un borde afilado definido debido a la incertidumbre de Heisenberg. El primero, el orbital 1s corresponde a un volumen al que se asocia con una probabilidad del 90% de encontrar una partícula localizada llamada electrón. Y esto representó la primera de muchas soluciones a la ecuación de onda de Schrödinger. Órbitas más grandes a medida que avanzamos alejándonos del núcleo, comienzan a tomar formas que no son capas esféricas.
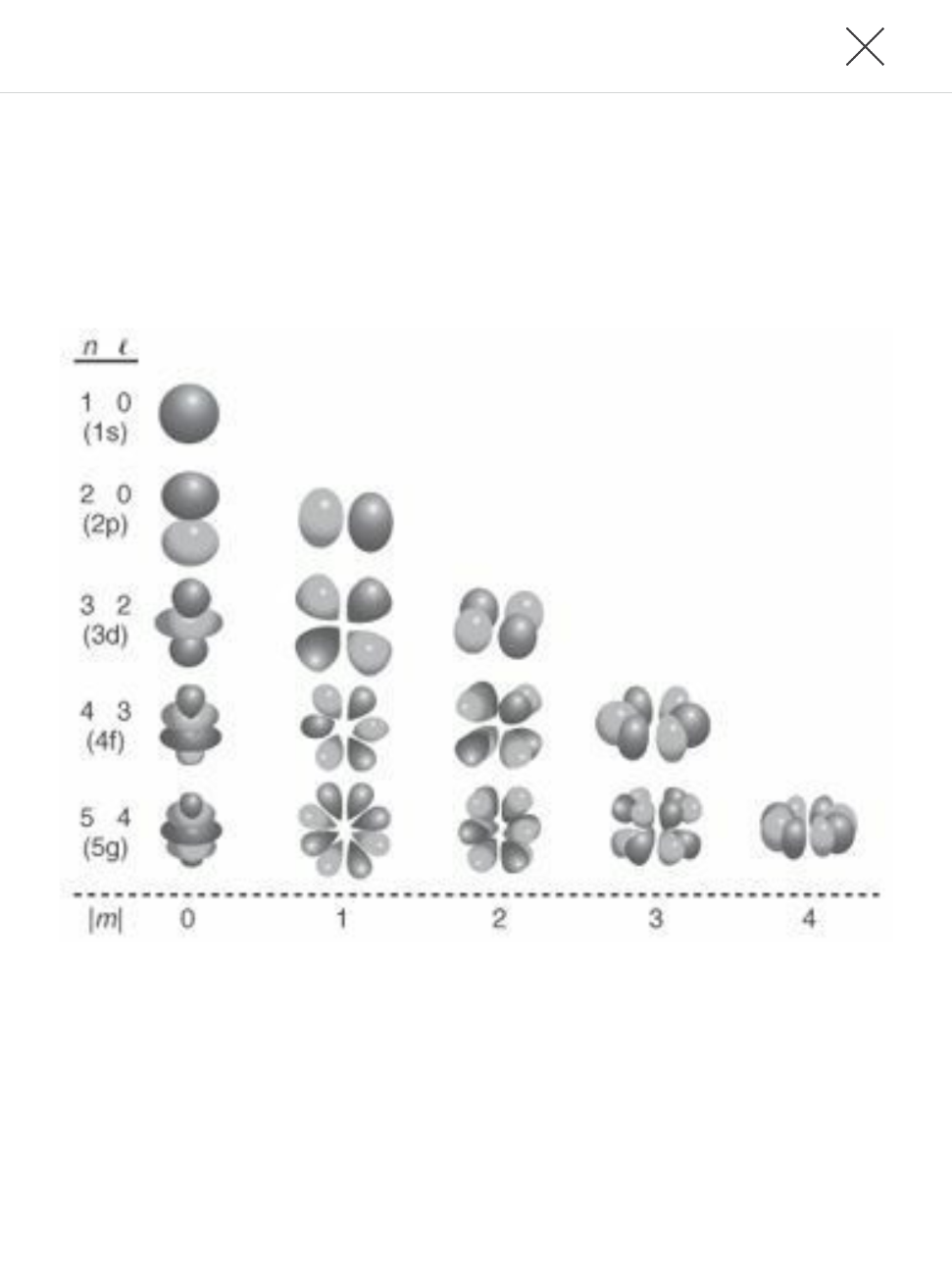
4.43 Orbitales s, p, d, y f
Al expandir el panorama sobre la concepción de la teoría cuántica, la mecánica cuántica y la Tabla periódica. Desde la introducción original de Bohr de la noción de cuantificación en el estudio de la estructura atómica para el átomo de hidrógeno. Presentando en los mismos trabajos originales, una nueva forma de explicar la Tabla periódica asumiendo que la cuantización de la energía también tenía lugar en átomos que contenían muchos electrones. La introducción subsecuente de tres números cuánticos, además del primer número cuántico de Bohr, permitieron explicar mejor la Tabla periódica. E incluso anterior a estas contribuciones J. J. Thomson había comenzado a especular sobre los arreglos de los electrones en los diferentes átomos que forman la Tabla periódica.
Por lo tanto, la Tabla periódica ha servido como campo de pruebas para las teorías de la física atómica y por muchos aspectos tempranos de la teoría cuántica y de la mecánica cuántica más adelante. La situación que existe hoy es esa química, y en particular la Tabla periódica es considerada explicada completamente por la mecánica cuántica. Aunque no es absolutamente es el caso, su papel explicativo continúa siendo innegable, pero en el actual clima reduccionista parece olvidarse que la Tabla periódica condujo al desarrollo de muchos aspectos de la mecánica cuántica moderna y por lo que es algo contradictorio intentar justificar que solo el último explica al anterior.
4.44 Alquimia moderna; elementos faltantes de los elementos sintéticos
La Tabla periódica consta de alrededor de 90 elementos que existen naturalmente, terminando con el elemento 92, el uranio. Algunos elementos como el tecnecio fueron sintetizados y tiempo después se reportó su existencia de forma natural en la tierra.
Químicos y físicos han logrado sintetizar algunos de los elementos que faltaban entre el hidrógeno (1) y el uranio (92). Aunados a estos han sido sintetizados un número significativo de ellos, 25 nuevos elementos más allá del uranio, aunque nuevamente uno o más de ellos como el Neptuno o el plutonio más tarde fueron encontrados naturalmente en cantidades extremadamente pequeñas.
Hasta lo reportado por la escritura, el elemento más pesado que existe sustentado en evidencias experimentales es el elemento 118. Todos los demás elementos entre 92 y 118 han sido exitosamente sintetizados, como el elemento 117 anunciado en abril de 2010.
La síntesis de muchos elementos involucrados a partir de un núcleo particular sometiéndolo al bombardeo de partículas pequeñas con el objetivo de aumentar su número atómico y por lo tanto, transformar la identidad del núcleo en cuestión. Más recientemente ha cambiado el método de síntesis, implicando la colisión de núcleos de peso considerable con un nuevo objetivo, formar un núcleo más grande y más pesado.
Hay un sentido fundamental en el que todas estas síntesis son descendientes de un experimento crucial llevado a cabo por Rutherford y Soddy, en 1919 en University Of Manchester. En el experimento se bombardearon núcleos de nitrógeno con partículas alfa (iones de helio) con lo que el núcleo del nitrógeno se transformó en otro elemento. Aunque no lo notaron en un principio, la reacción había producido un isótopo del oxígeno. Rutherford había logrado la primera transmutación de un elemento en uno completamente diferente. El sueño de los antiguos alquimistas se había convertido en una realidad y este proceso general ha continuado produciendo nuevos elementos hasta la actualidad.
Sin embargo, esta reacción no produjo un nuevo elemento pero si un isótopo inusual de un elemento existente. Rutherford utilizó partículas alfa producidas por el decaimiento radioactivo de otros núcleos inestables como el del uranio. Pronto se supo que transmutaciones similares podrían llevarse a cabo con átomos de destino distintos del nitrógeno pero que se limitan al calcio elemento con número atómico de 20. Núcleos más pesados para ser transmutados requerirían de más proyectiles que los naturalmente producidos por las partículas alfa.
La situación cambió en la década de 1930, por la invención del Cyclotron por Ernest Lawrence en University of California, Bekerley. Esta máquina hacía posible acelerar partículas alfa a cientos y hasta miles de veces superiores que la velocidad poseída por las partículas alfa producidas naturalmente. Además, otro proyectil de partículas, el Neutrón fue descubierto en 1932 con la ventaja de poseer una carga eléctrica de cero lo que significaba que podría penetrar en un átomo destino sin sufrir repulsión por los protones cargados positivamente contenidos en el núcleo.
4.45 Elementos faltantes
A mediados de la década de 1930, cuatro lagunas permanecían en espera para ocupar los espacios vacíos en la Tabla periódica. Consistían en elementos con números atómicos de 43, 61, 85 y 87. Curiosamente tres de estos elementos habían sido incluidos en las predicciones de Mendeleev, nombrados como eka-manganeso (43), eka- yodo (85) y eka-cesio (87).
En 1937, se realizaron nuevos experimentos, en los que un blanco de molibdeno fue bombardeado con proyectiles de deuterio (isótopo del átomo de hidrógeno, con dos veces la masa del isótopo más abundante). Uno de los investigadores, Emilio Segre un becario postdoctoral tomó las placas irradiadas en Silicia y junto con Perrier analizaron las placas y fueron capaces de confirmar la formación de un nuevo elemento, el elemento número 43, el tecnecio.
42Mo + 1H→43Tc + 0n
Este fue el primer nuevo elemento obtenido por trasmutación a 18 años del experimento trascendental de Rutherford. Rastros del nuevo elemento tecnecio, más tarde fueron encontrados de modo que existe naturalmente en la tierra en cantidades extremadamente pequeñas.
El elemento 85, eka-yodo de Mendeleev, fue el segundo elemento que faltaba de ser descubierto como resultado de la síntesis artificial. Tomando en consideración su número atómico de 85 pudo haber sido formado de polonio (84) o bismuto (83). El polonio es muy inestable y radioactivo así que la atención se centró en el bismuto, que corresponde realmente el último de los elementos estables, mientras que todos los subsiguientes decaen por radioactividad. Dado que el número atómico del bismuto es dos unidades menor que el elemento 85, el proyectil de bombardeo debería corresponder una vez más a una partícula alfa. En 1940, Corson, Mackenzie y Segré realizaron un experimento en Bekerley en el que obtuvieron un isótopo del elemento 85 con una vida media de 8.3 horas nombrado astato del griego astatos que significa instable. El tercer elemento en espera de ser sintetizado artificialmente fue el elemento 61 que nuevamente en el cyclotron con un equipo conformado por Marinsky, Glendenin y Coryell desarrollaron una reacción que involucraba la colisión de átomos de neodimio con átomos de deuterio.
Un cuarto elemento faltante había sido descubierto por el químico Marguerite Perey en 1939. Quien trabajaba como ayudante del laboratorio de Madame Curie sin contar en el momento del descubrimiento de un título universitario confiriéndole el nombre de Francio. Este elemento no requiere de una síntesis artificial pero fue encontrado como el subproducto de la desintegración radiactiva natural del actinio. Perey eventualmente ascendió a catedrático y posicionarse en la dirección de la institución principal para la química nuclear de Francia.
4.46 Elementos transuránicos
Finalmente llegamos a la síntesis de los elementos más allá del intervalo natural 1-92, del hidrógeno y uranio respectivamnte. En 1934, tres años antes de la síntesis del tecnecio, Enrico Fermi comenzó a bombardear elementos objetivos con neutrones con la esperanza de sintetizar elementos transuránicos. Fermi creyó haber tenido éxito en la producción de dos elementos que puntualmente nombró ausonium (neptunio 93) y hesperium (plutonio 94). Pero no podría haber sido de ese modo.
Después de anunciar sus resultados en su discurso de aceptación del Premio Nobel de ese año, él rápidamente se retractó de su afirmación produciendo una versión escrita de su presentación. La explicación de las erróneas afirmaciones surgió un año más tarde en 1938 por Otto Hahn, Fritz Strassmann y Lise Meitner con el descubrimiento de la fisión nuclear. Quedó claro que, en colisión con un neutrón, el núcleo de uranio por ejemplo, podía fragmentar al núcleo generando dos núcleos de tamaño mediano en lugar de un núcleo más grande. Por ejemplo, el uranio era capaz de formar cesio y rubidio según la siguiente reacción de fisión.
92U+0n→55Cs + 37Rb
Fermi y sus colaboradores habían estado observando estos productos de los procesos de fisión nuclear en lugar de formar núcleos más pesados como creyeron en un inicio.
4.47 Elementos transuránicos reales
La verdadera identificación de elemento 93 finalmente la realizó en 1939, Edwin McMillan y sus colaboradores en Bekerley. Fue nombrado neptunio porque subsiguió al uranio en la tabla periódica tal y como el planeta Neptuno sigue al Urano respecto de su distancia al sol. Un químico del equipo Philip Abelson, descubrió ese elemento 93, que no se comportaba como eka-renio, como se esperaba por su presunta posición en la Tabla periódica fue en base a esto y en acuerdo con resultados similares para el elemento 94, o plutonio que Glen Seaborg propuso una significativa modificación en la Tabla periódica. Como resultado, los elementos a partir del actinio (89) ya no eran considerados como elementos de transición sino como análogos de la serie de los lantánidos. En consecuencia, no sería necesario que elementos como el 93 y 94 se comportaran como eka-reino y eka-osmio puesto que habían emigrado a diversos lugares de la Tabla periódica preestablecida.
La síntesis de los elementos 94 a 97 inclusive llamados plutonio, americio, curio y berkelio aparecieron en los años restantes de la década de 1940 y el número 98, llegada la década de 1950. Pero esta secuencia parecía estaba a punto de terminar desde el núcleo más pesado que presentaba la mayor inestabilidad. El problema se convirtió en una necesidad de acumular suficientes materiales destino con la esperanza de que en un bombardeo con neutrones los elementos se transformaran en un elemento más pesado. En este punto intervino la serendipia. En 1952, se llevó a cabo una explosión de prueba termonuclear, nombrada en clave Mike, cerca de las islas Marshall en el océano pacífico. Uno de los resultados fue la producción de intensos flujos de neutrones, sin los que este tipo de reacciones no hubieran sido posibles en ese momento. Por ejemplo el isótopo u-238 puede incidir con 15 neutrones para formar u-253 que posteriormente sufre la pérdida de siete de las partículas beta, dando por resultado la formación del elemento 99, llamado einstenio.
El elemento 100 llamado Fermio, fue producido de manera similar como consecuencia del alto flujo de neutrones producidos por si mismo, por explosión, como lo revelado en las islas cercanas al pacifico.
4.48 Elementos del 101 al 106
Avanzando aún más a lo largo de la secuencia de núcleos cada vez más pesados requiere un enfoque muy diferente dado que el decaimiento beta no tiene lugar para los elementos por encima de Z=100. Numerosas innovaciones tecnológicas fueron requeridas incluyendo el uso de aceleradores lineales en lugar de ciclotrones, permitiendo a los investigadores acelerar haces intensos de iones a energías bien controladas. Las partículas proyectadas también debían ser más pesadas que los neutrones o las partículas alfa. Durante la guerra fría los únicos que poseían estas instalaciones especializadas fueron Estados Unidos y la Unión soviética. En 1955, el mendelevio elemento 101 fue producido de esta manera en el acelerador lineal de Berkeley.
Las posibles combinaciones de los núcleos se volvieron más numerosas. Por ejemplo el elemento 104 o rutherfordio, fue producido en Berkeley por la siguiente reacción.
 18.18.25.png)
En Dubna, Rusia fue creado un isótopo diferente del mismo elemento por la siguiente reacción.
 18.19.05.png)
En total, seis elementos del 101 al 106 fueron sintetizados mediante este enfoque generando disputas sobre los créditos de su descubrimiento entre las dos potencias. Pero habiendo llegado al elemento 106, se presentó un nuevo problema que solo sería resuelto al adoptar un innovador enfoque. La nueva tecnología fue llamada “fusión fría” pero no en el sentido del tipo de fusión fría que ocurre en el fondo de un tubo de ensayo, en lo anunciado por los químicos Martin Fleischmann y Satanley Pons en 1989.
La fusión fría en el campo de los elementos transuránicos es una técnica en la que los núcleos se hacen colisionar unos con otros a velocidades más lentas de las que fuesen empleadas con anterioridad. Como resultado, se genera menos energía, y por lo tanto existe la posibilidad de la disminución del núcleo combinado y este pueda separarse. Esta técnica fue ideada originalmente por Yuri Oganessian un físico soviético, pero culminó su desarrollo en Alemania.
4.49 Elementos a partir del 107
En la década de 1980, los elementos 107 (bohrio), 108 (hassio) y 109 (meitnerio) se sintetizaron con éxito en Alemania empleando el método de fisión fría. Pero entonces llegaron a ser evidentes otras posibilidades. Muchas nuevas ideas y técnicas fueron evaluadas al mismo tiempo en colaboración entre Estados Unidos y Alemania, y lo que ahora se había convertido en Rusia. En 1994, después de 10 años de estancamiento, el laboratorio alemán Darsmstadt anunció la síntesis del elemento 110 formado por las colisiones de plomo e iones de níquel.
La vida media del isótopo resultante fue de apenas 170 microsegundos. Los alemanes llamaron al nuevo elemento darmstadio haciendo honor al laboratorio en el que se desarrolló su descubrimiento. Un mes más tarde, habían obtenido el elemento 111 más adelante nombrado roentgenio rindiendo honor a Röntgen, el descubridor de rayos X. En febrero de 1996 se apreció la síntesis subsecuente del elemento 112, oficialmente nombrado copernicio en el 2010 y que continúa siendo oficialmente el elemento más pesado hasta el momento en que se escriben estas líneas.
4.50 Elementos entre 113 y 118
Desde 1997, han sido publicadas varias demandas para la síntesis de los elementos del 113 al 118. El último elemento 117 fue sintetizado en el 2010. Esta situación se entiende dado que los núcleos con un número impar de protones son invariablemente más inestables que aquellos con un número par de protones. Esta diferencia de estabilidad se produce porque tanto protones como electrones tienen un spin medio y en el caso de los electrones acceden a los orbitales de energía de dos en dos, con spin opuestos.
Siguiendo que átomos con números par de protones con frecuencia producen spin (giros) totales de cero y por tanto sus núcleos son más estables que los núcleos con un protón desapareado con un spin no compensado, como ocurre en los núcleos con números impares de protones como el 115 y 117. La síntesis del elemento 114 era muy esperada porque se había predicho desde hacía tiempo argumentando representaría una “isla de estabilidad”, es decir una porción de la Tabla periódica de núcleos con mayor estabilidad. El elemento 114 fue afirmado por el Laboratorio Dubna en 1998, pero fue definitivamente hasta 1999 mediante otros experimentos que implicaban la colisión de un blanco de plutonio con iones de calcio 48 que los laboratorios Berkeley y Darmstard confirmaron este hallazgo. En el momento de escribir algo parecido ocurrió con el decaimiento del elemento 114 que culmina en elemento 80 siendo registrado exitosamente. Alrededor de 30 elementos provienen del decaimiento de núcleos más pesados como el 116 y 118. El isótopo de larga vida del elemento 114 tiene una masa de 289 y una vida media de 2,6 segundos y de acuerdo, a las predicciones este sería el elemento que presentaría mayor estabilidad.
En diciembre de 1988, los laboratorios de Bubna-Livermore publicaron un documento conjunto, demandando que el elemento 118 había sido apreciado como consecuencia de la siguiente reacción.
36Kr + 82Pb → 118Uuo +0n
Después de varios intentos fallidos de reproducir este resultado en Japón, Francia y Alemania, la demanda fue retraída oficialmente en julio del 2001.
Un par de años más tarde nuevas demandas fueron pronunciadas por el Labotarorio Dubna, que prosiguieron en el 2006 con las del laboratorio Lawrence-Livermore, en California. Colectivamente científicos de Estado Unidos y Rusia hicieron un reclamo más pronunciado, habían detectado cuatro decaimientos más para el elemento 118, mediante la siguiente reacción.
98Cf+ 20Ca → 118 Uuo + 30n
Los investigadores están muy seguros de que los resultados son confiables puesto que la posibilidad de que las detecciones fuesen eventos al azar se estimaban en menos de una parte por 100,000. No han sido realizados más experimentos debido a la escasez de los átomos producidos y su vida media de menos de un milisegundo.
En el 2010, un elemento más inestable, el número 117 fue sintetizado y caracterizado por un amplio equipo de investigadores trabajando en Dubna, así como varios laboratorios de Estados Unidos. La tabla periódica ha llegado a un punto interesante en el cual, todos los 118 elementos existen en la naturaleza o han sido creados artificialmente por experimentos especiales. Esto incluye un número notable de 26 elementos más allá del elemento uranio, que han sido tradicionalmente considerados en algún momento como el último de los elementos que existen naturalmente. En el momento de la escritura hay incluso planes para intentar la síntesis de elementos aún más pesados como el elemento 119 y 120 y no existen razones para pensar que deba existir un fin inmediato de la secuencia de elementos que pueden formarse.
4.51 Química de la síntesis de los elementos
La existencia de elementos superpesados plantea una interesante nueva pregunta y también un desafío para la Tabla periódica. También ofrece un interesante nuevo punto de encuentro para que las predicciones teóricas sean enfrentadas con los resultados experimentales. Cálculos teóricos sugieren que los efectos de la relatividad cada vez son más importantes como la carga nuclear se incrementa en los átomos. Por ejemplo el color característico del oro, con un número atómico que podría suponerse modesto de 79, es explicado por apelación a la teoría de la relatividad. Cuanto mayor sea la carga nuclear más rápido es el movimiento de los electrones en los orbitales internos. Como consecuencia de la obtención de velocidades relativistas los electrones interiores se aproximan más al núcleo, y esto a su vez tiene el efecto de causar una mayor proyección en los electrones más exteriores que determinan las propiedades químicas de cualquier elemento particular. Se ha previsto que algunos átomos podrían comportarse de una manera químicamente inesperada desde su presunta posición en la Tabla periódica.
Los efectos relativistas representan por lo tanto el último reto para poner a prueba la universalidad de la Tabla periódica. Predicciones teóricas han sido publicadas por varios investigadores a lo largo del tiempo, pero fue solo cuando los elementos 104 y 105, rutherfordio y dubnio respectivamente fueron químicamente evaluados que la situación llegó a conciliarse. Encontrándose que el comportamiento químico del rutherfordio y dubnio en realidad era bastante diferente de los que intuitivamente se esperaría por la posición que ocupan en la Tabla periódica. El rutherfordio y dubnio no parecen comportarse como el hafnio y tantalio, respectivamente como deberían haberlo hecho.
Por ejemplo, en 1990, K. R. Czerwinski, trabajando en Berkeley, informó que la química de la solución del elemento 104 o rutherfordio, se diferenció de la del circonio y hafnio los dos elementos en los bordes horizontales a este. Mientras tanto, informó que la química del rutherfordio se asemejaba a la del plutonio elemento que se encuentra ubicado bastante distanciado en la Tabla periódica. En cuanto al dubnio, los primeros estudios demostraron de manera similar que no poseía un comportamiento químico semejante al elemento por encima de él, el tantalio. De hecho mostraba una mayor similitud con los elementos de los actínidos, el protactinio. En otros experimentos rutherfordio y dubnio parecían asemejarse en su comportamiento a dos elementos por encima del hafnio y tantalio, es decir el circonio y el niobio.
Fue solo cuando la química de los siguientes elementos seaborgio (106) y bohrio (107) se examinó que se demostró que su comportamiento periódico no era el esperado. Los títulos de los artículos en los que fueron publicados estos descubrimientos no dejaban lugar a la interpretación. Incluyendo “Curiosamente el excepcional seaborgio” y “El aburrido bohrio” ambas referidos al hecho que era un asunto asumido por la Tabla periódica. A pesar de que los efectos relativistas deben ser aún más pronunciados para estos dos elementos, el comportamiento químico separado mostrado por cada uno parece compensar estas tendencias.
El descubrimiento de las tríadas fue el primer indicio de una regularidad numérica en las propiedades de los elementos en un grupo común, y desde este aborde se había sugerido que el bohrio podría ser integrado en el grupo 7 de la Tabla periódica. A continuación se presentan las mediciones realizadas en las entalpias estándar de sublimación (energía necesaria para convertir un sólido en un gas) de los compuestos análogos del tecnecio, renio y bohrio con oxígeno y cloro.
TcO3Cl=49 kJ/mol
ReO3Cl=66 kJ/mol
BhO3Cl= 89kJ/mol
Predecir el valor del BhO3Cl utilizando el método de la tríada genera un valor de 83kJ/mol o un error de solamente 6.7% en comparación con el valor experimental por encima de 89 kJ/mol. Este hecho apoyó más la noción de que el bohrio se comporta como un elemento genuino del grupo 7.
Mn
Te
Re
Bh
El desafío de la Ley periódica desde los efectos relativistas se convirtió aún más pronunciado en el caso del elemento 112 o copernicio, el elemento más reciente en el desarrollo de experimentos químicos. Una vez más cálculos relativistas indicaban un comportamiento químico modificado en la medida de que se cree que el elemento podría comportarse como un gas noble y no como el mercurio por debajo del cual se coloca en la Tabla periódica. Experimentos desarrollados de las entalpias de sublimación en el elemento 112 demostraron que contrario a las expectativas anteriores, su naturaleza química le confiere un lugar en el grupo 12 junto al zinc, cadmio y mercurio.
El elemento 114 presentó una historia similar, los primeros cálculos y experimentos sugieren un comportamiento de gas noble pero experimentos más recientes apoyan la noción de que el elemento presenta un comportamiento semejable con el del metal plomo como se esperaba por su disposición en el grupo 14 de los elementos. La conclusión parece ser que la periodicidad química es un fenómeno extraordinariamente robusto. Ni los poderosos efectos relativistas debido al rápido movimiento de electrones en torno al núcleo parecen capaces de derrotar a un simple descubrimiento científico postulado hace unos 150 años.
4.52 Formas de la tabla periódica
Mucho se ha dicho sobre la Tabla periódica pero ¿Por qué hay tantas Tablas periódicas publicadas y por qué tantas se presentan actualmente ofertándose en libros de texto, los artículos y en internet? ¿existe una Tabla periódica ideal? Una pregunta que aún parece tener sentido, y si es así ¿Qué progresos se han realizado hacia la identificación de la supuesta Tabla periódica ideal?
En su libro clásico sobre la historia de la Tabla periódica, Edward Mazurs incluye ilustraciones, así como referencias de cerca de 700 tablas periódicas que han sido publicadas desde la presentada en la década de 1860. En los 40 años que han transcurrido desde la publicación del libro de Mazurs, han aparecido al menos otras 300 nuevas Tablas periódicas, especialmente si se incluyen los Sistemas periódicos publicados en internet. El hecho de que muchas Tablas periódicas existan es algo que demanda una explicación. Por supuesto muchas de estas Tablas no tienen nada nuevo que ofrecer y algunas pueden ser inconsistentes desde el punto de vista científico. Pero incluso si tuviéramos que eliminar estas publicaciones engañosas sigue siendo un enorme número de Tablas periódicas.
De las tres formas básicas de la Tabla periódica, formato corto, formato medio largo y formato largo, todas ellas convergen transmitiendo la misma información, aunque como se señaló, la agrupación de elementos con la misma valencia se aborda diferentemente en cada uno de estos formatos. Además, hay Tablas periódicas que no parecen una Tabla en el sentido estricto de que no tienen forma rectangular. Una variación muy importante de este tipo lo incluye los Sistemas periódicos circulares y elípticos que sirven para resaltar la continuidad de los elementos de una forma que tal vez es mejor que las formas rectangulares. En Sistemas circulares o elípticos no existen discontinuidades al final de los periodos como ocurre en los formatos rectangulares entre digamos neón y sodio o argón y potasio. Pero varían las longitudes de los periodos, a diferencia de los periodos en una cara de reloj. Como resultado, el diseñador de la Tabla periódica circular necesita dar cabida a los periodos más largos que tienen de alguna manera elementos de transición. Por ejemplo la tabla de Benfey hace esto mediante el uso de cúmulos para los metales de transición que sobresalen del sistema circular principal.

Sistema periódico de Benfey
Hay Tablas periódicas tridimensionales como la diseñada por Fernando Dufour de Montreal.

4.53 Árbol periódico de dufour
Pero sugeriremos que todas estas variaciones implican solo la modificación de la forma del Sistema periódico sin existir diferencias fundamentales entre ellas. Lo que constituye una variación importante es la colocación en uno o más elementos dentro de un grupo diferente a donde se encuentra en una Tabla periódica convencional.
La tabla periódica es un concepto aparentemente simple o es como suele mostrarse. Esto es lo que invita a los científicos aficionados a probar su talento en el desarrollo de nuevas versiones que a menudo afirman poseer propiedades superiores que todos los sistemas periódicos previamente publicados. Por otra parte ha habido un número significativo de aportes por aficionados extraños al campo de la física y química como Anton van den Broek que instauró la noción del número atómico, una idea que desarrolló en diversos artículos publicados en revistas como Nature. Un segundo ejemplo lo representa Charles Janet un ingeniero francés quién en 1929 publicó la primera versión conocida del Sistema periódico con un avance hacia la izquierda que continúa en el centro de atención de muchos aficionados y académicos expertos de la Tabla periódica.
La filosofía del sistema periódico. Si se cree en la repetición aproximada de las propiedades de los elementos es un hecho objetivo del mundo natural, entonces se adopta una actitud realista. Para algunas personas la búsqueda de una Tabla periódica óptima tiene un sentido perfecto. La tabla periódica óptima sería aquella que mejor represente los hechos en cuestión relativos a la periodicidad química, aunque muy posiblemente esta no ha sido descubierta.
Por otro lado un instrumentista o un antirrealista respecto a la Tabla periódica podría creer que la periodicidad de los elementos es una propiedad que se impone a la naturaleza por agentes humanos. Si este es el caso, ya no sería un ardiente deseo de descubrir la Tabla periódica ideal puesto que no existe, no ha sido dimensionada aún. Para tal convencionalista o antirrealista, no importa precisamente como se representan los elementos ya que cree que se trata de un posicionamiento artificial en lugar de una relación natural entre los elementos.
Tomando una posición realista puede parecer inconcebible que al cuestionar a algunos químicos académicos sobre si el elemento hidrógeno pertenece al grupo 1 (metales alcalinos) o a al grupo 17 (halógenos) algunos respondan no es importante.
La utilidad de la Tabla periódica, muchos científicos tienden a favorecer una u otra forma particular de la tabla periódica porqué puede ser de mayor uso conveniente a ellos en su trabajo científico como astrónomo, geólogo o físico y así sucesivamente, estas Tablas periódicas se basan primordialmente en su utilidad, mientras que otras intentan mostrar la verdad más profunda de los elementos, por no tener una mejor expresión. Una Tabla periódica que busque reunir la verdad más íntima de los elementos llegará a ser útil interdisciplinariamente pues de tener éxito capturará de alguna manera la naturaleza y relación de los elementos referidos a su periodicidad.
Otro aspecto importante es la simetría. Muchos defensores de las Tablas periódicas alternativas afirman su propuesta es superior porqué los elementos son representados de manera más simétrica o de alguna manera más elegante o hermosa. La cuestión de la simetría y belleza en ciencia ha sido muy debatido, pero como con todas las cuestiones estéticas, lo que puede parecer hermoso a una persona puede no ser compartido por otros. Debe serse cuidadoso al tratar de imponer belleza o regularidad en la naturaleza donde no podría realmente estar presente. Muchos autores de tablas alternativas parecen discutir exclusivamente sobre la regularidad de su representación y se olvidan que no se pretende demostrar el mismo mundo químico, si existiese una manera de representarlo.
4.54 Algunos casos concretos
Empecemos con la Tabla periódica con avance hacia la izquierda que es uno de los sistemas periódicos sustancialmente diferente en el que los elementos se colocan en diferentes grupos que en las Tablas convencionales. Propuesto por Charles Janet en 1929, poco después del desarrollo de la mecánica cuántica, contrario a lo que podría suponerse esta no tomaba en consideración a la innovadora teoría basándose enteramente en principios estéticos. Pero pronto quedó claro que algunas características principales del avance hacia la izquierda podrían correlacionarse mejor con la mecánica cuántica de los átomos que las Tablas convencionales.
En primer lugar ¿Qué es la Tabla periódica de avance hacia la izquierda y como difiere de otras Tablas periódicas? La Tabla periódica de avance hacia la izquierda se obtiene moviendo el elemento helio desde la parte superior de los gases nobles (grupo 18) a la parte superior de los metales alcalinotérreos (grupo 2). Los dos grupos de la izquierda de esta Tabla se mueven entonces a la orilla derecha para formar una nueva Tabla. Además el bloque 28 de los elementos de las tierras raras que usualmente se presentan como una nota inferior se mueven hacia la izquierda de la nueva Tabla. Como resultado, los elementos de las tierras raras se incorporan plenamente a la Tabla periódica a la izquierda del bloque de los metales de transición, generando una forma más regular y unificada. Además se obtienen dos periodos muy cortos en lugar de solo uno como se observa en las tablas periódicas convencionales y en lugar de longitudes anómalas que no se repiten, se presentan longitudes de periodos que se repiten una vez generando una secuencia 2, 2, 8, 8, 18, 18, etc. Janet no era consciente de la mecánica cuántica pero su introducción en la Tabla periódica resultó en una comprensión basada en las configuraciones electrónicas. En este enfoque, los elementos de la Tabla periódica se diferencian unos de otros según el tipo de orbital ocupado por el electrón diferenciador (el último electrón en entrar en el átomo en el proceso de llenado).
En las Tablas convencionales, los elementos de los dos grupos de la izquierda se dice que forman parte del bloque s porque sus electrones diferenciados se encuentran en un orbital s. Avanzando hacia la derecha, nos encontramos con el bloque d, aparece el bloque p y finalmente el bloque f, el último de los cuales se esconde debajo del cuerpo principal de la Tabla. Este ordenamiento de los bloques de izquierda a derecha no es lo más natural o como podrían esperarse, puesto que en cada capa la distancia desde el núcleo sigue el orden.
s<p<d<f
La Tabla periódica de avance hacia la izquierda mantiene este orden, aunque es un orden inverso. Si esto es realmente una ventaja es discutible, sin embargo puesto que el orden de llenado de orbitales toma la forma.
s<f<d<p
Que es perfectamente el mantenido, al menos en la tradicional de la Tabla de formato largo, en cómo los bloques están dispuestos de izquierda a derecha. Por otra parte el orden de llenado en lugar de la distancia de los electrones en diversos tipos de orbitales en torno al núcleo, es considerado más fundamental.
Pero esto puede ser otra de las ventajas desde el punto de vista de la mecánica cuántica. No se disputa el hecho de que la configuración electrónica del átomo de helio demuestra dos electrones, los cuales se encuentran en un orbital s. Esto debería hacer del helio un elemento del bloque s. Pero en Tablas periódicas convencionales el helio se coloca entre los gases nobles debido a sus propiedades químicas son altamente inertes al igual que los demás gases nobles (Ne, Ar, Kr, Xe, Rn). Para ello parece haber dos posibilidades.
- La estructura electrónica no es el principio rector final para el acomodo de los elementos en grupos y bien puede ser reemplazado por un nuevo criterio en un momento oportuno (por ejemplo, el peso atómico, eventualmente fue reemplazado por el número atómico en la ordenación de los elementos, resolviendo el problema de inversiones de par entre el yodo y el telurio).
- Las reglas de configuración electrónica son oportunas, con lo que la química aparentemente inerte del helio debería ser ignorada.
4.55 Un nuevo criterio preservar o crear nuevas triadas
Puede ser un criterio más fuerte y más positivo (porque si en lugar de no) para decidir sobre la colocación del helio o cualquier otro elemento. Este nuevo criterio representa algo cercano a un círculo completo en cuanto la elaboración de la Tabla periódica. Recordemos como el primer indicio de cualquier regularidad numérica de los elementos llegó en 1817 con el descubrimiento de Döbereiner de tríadas de elementos como litio, sodio y potasio donde el peso atómico del elemento central tiene un valor intermedio entre los dos elementos de acompañamiento. Pero el principio de ordenación que consistía en el peso atómico fue sustituido por el del número atómico. ¿Qué hace este cambio de la existencia de las tríadas de los elementos en la Tabla periódica? La respuesta es reforzar el concepto, puesto que las tríadas del anterior peso atómico eran aproximadas, se convierten en tríadas de un número atómico exacto.
 12.45.16.png)
Ahora consideremos las tríadas correspondientes al número atómico.
 12.45.22.png)
Mientras que los pesos atómicos, de sodio y bromo corresponden aproximadamente a los promedios obtenidos de los elementos que los acompañan, los números atómicos del sodio y bromo son los promedios exactos de los elementos por los que se acompañan.
¿Y si intentamos resolver la ordenación del helio en la Tabla periódica empleando el número atómico de triadas? El resultado de la aplicación de este enfoque es muy obvio. Si el helio permanece en su lugar tradicional entre los gases nobles, formaría una tríada perfecta del número atómico.
 12.44.21.png)
Si el helio se moviera al grupo de metales alcalinotérreos, sin embargo, como se hace en la tabla periódica de avance hacia la izquierda solo conseguimos destruir una perfecta tríada del número atómico.
 12.45.53.png)
Mismo criterio aplicado a otros elementos difíciles de colocar
Otro de los elementos que tradicionalmente ha causado problemas es el primero, es decir el hidrógeno. En términos químicos parece pertenecer al grupo 1 de (metales alcalinos) debido a su capacidad de formar +1 iones de H+. Por otra parte es algo único que también posea la capacidad de formar iones de la forma H- , como en el caso de los hidruros metálicos NaH, CaH2, etc. Este comportamiento admite la colocación del hidrógeno en el grupo 17 (halógenos) que primordialmente forman iones de la forma -1. ¿Cómo puede este problema resolverse categóricamente? Algunos autores toman una manera sencilla permitiendo al hidrógeno “flotar” majestuosamente por encima del cuerpo principal de la tabla periódica, en otras palabras, no muestran compromiso con ninguna de sus posibles colocaciones.
Esto puede parecer la exposición de un etilismo químico que parece dar a entender que mientras todos los elementos están sujetos a la Ley periódica, el hidrógeno de alguna manera es un caso especial y como tal parece estar por encima de esta ley. ¿Por qué tratar de emplear tríadas de número atómico para resolver la cuestión de la colocación del hidrógeno? Como en el caso del helio, el resultado de este enfoque produce un resultado conciso aunque en un sentido distinto inclinándose a favor de la colocación del hidrógeno entre los halógenos en lugar de los metales alcalinotérreos. En la Tabla periódica convencional el hidrógeno se coloca como el primer elemento en el grupo de los metales alcalinotérreos, no existe una tríada perfecta, mientras que si permite al hidrógeno encabezar el grupo de los halógenos, una nueva tríada perfecta de número atómico aparece.
 12.46.11.png)
Al mostrar una consistencia entre el helio y el hidrógeno puede considerarse a las tríadas de número atómico como principio fundamental, el helio permanecería en el grupo 18, mientras que el hidrógeno podría ser trasladado al grupo 17
Tríadas del número atómico aplicadas al grupo 3 (térreos).
Ha persistido una larga disputa entre químicos y educadores químicos en relación con el grupo 3 de la Tabla periódica. Antiguas tablas periódicas mostraban los siguientes elementos en el grupo 3.
 12.46.48.png)
Más recientemente, Tablas periódicas en libros de texto comenzaron a mostrar elementos como.
 12.47.08.png)
Basados en argumentos de presuntas configuraciones electrónicas. En 1986 se publicó un influyente artículo por William Jensen de University of Cincinnati en el que se discutió persuasivamente respecto de autores de libros de texto y diseñadores de Tablas periódicas que se empeñaron en mostrar el grupo 3 como Sc, Y, Lu y Lr.
Incluso más recientemente, una acción de retirado ocurrió entre autores que han discutido el retorno a los elementos Sc, Y, La y Ac. ¿Cómo, si todos han mostrado resultados concisos en resistirse y emplear las tríadas de número atómico en el grupo 3? Si consideramos las tríadas de número atómico la respuesta es una vez más rápida y contundente favoreciendo la agrupación de Jensen. Mientras que la siguiente tríada es perfecta.
 12.47.24.png)
La segunda tríada es incorrecta.
 12.47.46.png)
Pero existe otra razón por la que el arreglo desarrollado por Jensen es el mejor y esto no depende de cualquier lealtad a las tríadas del número atómico. Si consideramos la Tabla periódica de formato largo el intento de incorporar al lutecio y laurencio o lantano y actinio en el grupo 3, solo la primera propuesta tiene sentido porque es el resultado de una secuencia continuamente creciente de números atómicos. Por el contrario la incorporación del lantano y actinio en el grupo 3 en una Tabla periódica de formato medio largo resulta en dos anomalías muy evidentes en términos de la secuencia de números atómicos crecientes.
La presentación de la Tabla periódica de esta manera requiere que el bloque d sea dividido en dos porciones muy desiguales que contiene un bloque con solo un elemento extraño y otro bloque con nueve elementos extraños. Dado que este comportamiento no ocurre en cualquier otro bloque de la Tabla periódica parece ser el menos probable de las tres Tablas periódicas posibles para reflejar la disposición real de los elementos en la naturaleza.
En términos de pruebas químicas y físicas no puede concebirse una resolución final de la disposición de los elementos en la Tabla periódica, su sentido de avance o sus principios rectores como podrían serlo las tríadas de números atómicos…, o cualquier noción sofisticada que inspire la pasión de un científico al refinamiento de la Tabla periódica.
Referencias
[1] Society, A. C. (2017). Chemistry in Context (9 ed.). McGraw-Hill Education.
[2] Fogler, H. S. (2016). Elements of Chemical Reaction Engineering (5th Edition) (Prentice Hall International Series in the Physical and Chemical Engineering Sciences) (5 ed.). Prentice Hall.
[3] Bell, M. S. (2006). Lavoisier in the Year One: The Birth of a New Science in an Age of Revolution (Great Discoveries) (1st Edition ed.). W. W. Norton & Company.
[4] J. M. S. T. E. I., Ness, H. C. V., Abbott, M., & Swihart, M. (2017). Introduction to Chemical Engineering Thermodynamics (8 ed.). McGraw-Hill Education.
[5] Sacks, O. (2002). Uncle Tungsten: Memories of a Chemical Boyhood (Reprint ed.). Vintage.
[6] Faraday, M. (2012). The Chemical History of a Candle., 81.
[7] Nwobosi, A. O., & Odokwo, E. (2019). ORGANIC NOMENCLATURE: SIMPLIFIED.: IUPAC System Made-Easy Book (Organic Chemistry 1).
[8] McNaught, A. D., & Wilkinson, A. (1997). Compendium of Chemical Terminology (IUPAC Chemical Data) (2 ed.). Wiley.
[9] Solís, L. F. M. (2012). Los superconductores (La Ciencia Para Todos) (Spanish Edition) (4th ed. ed.). Fondo de Cultura Economica.
[10] Gautam, P. (2017). IUPAC Nomenclature of Organic Chemistry: Organic Chemistry is easy., 29.
[11] Rumble, J. (2018). CRC Handbook of Chemistry and Physics, 99th Edition (99 ed.). CRC Press.
[12] Scerri, E., & Restrepo, G. (2018). Mendeleev to Oganesson: A Multidisciplinary Perspective on the Periodic Table (1 ed.). Oxford University Press.
[13] Mendeleev, D. I. (2005). Mendeleev on the Periodic Law: Selected Writings, 1869 - 1905 (Dover Books on Chemistry).
[14] DK. (2017). The Elements Book: A Visual Encyclopedia of the Periodic Table. DK Children.
[15] Stoker, H. S. (2013). Introduction to Chemical Principles (11th Edition) (11 ed.). Pearson.
[16] Fitts, D. D. (1999). Principles of Quantum Mechanics: As Applied to Chemistry and Chemical Physics (1 ed.). Cambridge University Press.
[17] Kjelle, M. M., Whiting, J., & Kjelle, M. (2004). John Dalton and the Atomic Theory (Uncharted, Unexplored, and Unexplained) (Uncharted, Unexplored, and Unexplained: Scientific Advancements of the 19th Century). Mitchell Lane Publishers.
[18] Wenley, R. M., & Grifiths, A. B. (2016). John Dalton : the Founder of the Modern Atomic Theory. CreateSpace Independent Publishing Platform.
[19] Dalaton, J., Wollaston, W. H., & Thomson, T. (2010). Foundations of the Atomic Theory: Comprising Papers and Extracts by John Dalton, William Hyde Wollaston and Thomas Thomson, 1802-1808 (1911). Kessinger Publishing, LLC.
[20] Atkins, P., & Jones, L. (2009). Chemical Principles (Fifth ed.). W. H. Freeman.
[21] Ramsay, S. W., & McLewis, W. C. (1926). A System of Physical Chemistry, 2 Volumes (First Edition ed.). Longmans, Green and Co, London.
[22] Gordin, M. D. (2004). A Well-ordered Thing: Dmitrii Mendeleev And The Shadow Of The Periodic Table (1St Edition ed.). Basic Books.
[23] Moseley, H. (2018). Syllabus of a Course of Experimental Lectures on the Theory of Equilibrium: To be Delivered at the King’s College, London, in the October Term of the Year 1831.
[24] AA., V. V. (1958). Los isótopos radioactivos y sus aplicaciones. Traducción de Sofía Wollman. Lautaro, Colección Ciencia y Técnica, nº 9. 1958, Argentina.
[25] Bohr, N. (2017). Atomic Physics and Human Knowledge., 115.