Texto universitario

_____________________________
CAPÍTULO 7. Espectroscopía ultravioleta, visible y de fluorescencia
7.1 Introducción
La espectroscopía en el rango ultravioleta-visible (UV-vis) es una de las técnicas más comunes en el laboratorio de análisis de alimentos. Diversos ejemplos, como la cuantificación de macro componentes (carbohidratos totales por el método fenol-ácido sulfúrico), cuantificación de micro componentes (tiamina por el procedimiento triocromo fluorométrico), estimación de rancidez (estado de oxidación lipídica por la prueba de ácido tiobarbitúrico) y pruebas de vigilancia (inmuno análisis ligado a enzimas) están presentes en este libro. En cada caso, la señal analítica en la que se basa el ensayo es en de emisión o absorción de radiación en el rango UV-Vis. Esta señal puede ser inherente al analito, como la absorbancia de radiación en el rango visible por pigmentos, o resultado de una reacción química que involucra el analito, como el método colorimétrico basado en cobre de Lowry para el análisis de proteínas solubles.
La radiación electromagnética en la porción UV-Vis del espectro engloba las longitudes de onda de aproximadamente 200–700 nm. El rango UV es accesible para los análisis comunes de laboratorio va desde 200 hasta 350 nm (Tabla 7.1). Y el rango de Vis de 350 a 700 nm. El rango UV es incoloro para el ojo humano, mientras diferentes longitudes de onda en el rango visible tienen un color característico, que van desde el violeta de corta longitud de onda al final del espectro, el rojo con la longitud de onda más larga en el final del espectro[1]. La espectroscopía que utiliza radiación en el rango de UV-Vis puede dividirse en dos categorías generales, espectroscopía de absorbancia y fluorescencia, según el tipo de interacción radiación-materia que está siendo monitoreada. Cada uno de estos dos tipos de espectroscopía puede subdividirse en técnicas cualitativas y cuantitativas. En general, la espectroscopía de absorción cuantitativa es la más común de las subdivisiones dentro de la espectroscopía UV-Vis[2].
Tabla 7.1 Espectro de la radiación visible
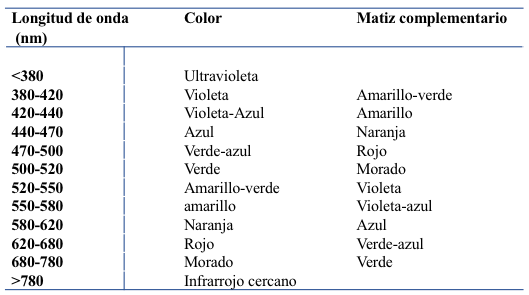
*La tonalidad complementaria se refiere al color observado para una solución que muestra la absorbancia máxima en la longitud de onda designada, suponiendo una fuente de luz de espectro continuo "blanco”.
7.2 Ultravioleta y espectroscopía de absorción visible
7.2.1 Bases de la espectroscopía de absorción cuantitativa
El objetivo de la espectroscopía de absorción cuantitativa es determinar la concentración de un analito en una solución de muestra dada. La determinación se basa en la medición de la cantidad de luz absorbida por un haz de referencia a medida que pasa a través de la solución de muestra. En algunos casos, el analito puede absorber naturalmente la radiación en el rango UV-Vis, de modo que la naturaleza química del analito no se modifica durante el análisis. En otros casos, los analitos que no absorben radiación en el rango de UV-Vis se modifican químicamente durante el análisis, convirtiéndolos en una especie que absorbe radiación de la longitud de onda adecuada. En cualquier caso, la presencia de analito en la solución afectará la cantidad de radiación transmitida a través de la solución y, por lo tanto, la transmitancia o absorbancia relativa de la solución puede usarse como un índice de concentración de analito.
En la práctica real, la solución a analizar está contenida en una celda de absorción y se coloca en la trayectoria de radiación de una o varias longitudes de onda seleccionadas. La cantidad de radiación que pasa a través de la muestra se mide en relación con una muestra de referencia. La cantidad relativa de luz que pasa a través de la muestra se usa para estimar la concentración del analito. El proceso de absorción se ilustra en la Figura 7.1. La radiación incidente en la celda de absorción, P0, tendrá una potencia radiante significativamente mayor que la radiación que sale del lado opuesto de la celda, P. La disminución de la potencia radiante a medida que el haz pasa a través de la solución se debe a la captura (absorción) de fotones por las especies absorbentes. La relación entre la potencia del haz incidente y el que sale normalmente se expresa en términos de transmitancia o de absorbancia de la solución. La transmitancia (T) de una solución se define como la relación de P a P0 mostrada en la ecuación 7.1.
T = P/P0 (7.1)
La transmitancia puede expresarse en porcentaje como se muestra en la ecuación 7.2:
%T = (P/Po) x 100 (7.2)
Donde:
T= Transmitancia
P0= Poder radiante del láser incidente en la celda de absorción
P= Poder radiante del láser saliendo de la celda de absorción
%T= Porcentaje de transmitancia
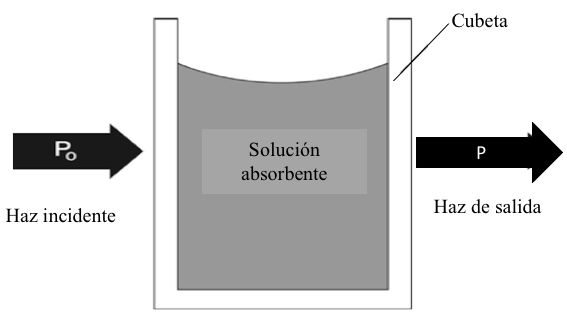
Figura 7.1 Atenuación de un haz de radiación a medida que pasa a través de una cubeta que contiene una solución absorbente.
Los términos T y %T son intuitivamente atractivos, ya que expresan la fracción de la luz incidente absorbida por la solución. Sin embargo, T y %T no son directamente proporcionales a la concentración del analito absorbente en la solución de muestra. La relación no lineal entre la transmitancia y la concentración es un inconveniente ya que los analistas están generalmente interesados en las concentraciones de analitos. Un segundo término utilizado para describir la relación entre P y P0 es la absorbancia (A). La absorbancia definida con respecto de T se expresa como sigue:
A = log(P0/P) = -logT = 2 - log%T
La absorbancia es una expresión conveniente porque, en condiciones apropiadas, es directamente proporcional a la concentración de las especies absorbentes en la solución. Tenga en cuenta que según estas definiciones para A y T, la absorbancia de una solución no es simplemente la unidad menos la transmitancia. En la espectroscopía cuantitativa, la fracción del haz incidente que no se transmite no es igual a la absorbancia de la solución (A).
La relación entre la absorbancia de una solución y la concentración de las especies absorbentes se conoce como la ley de Beer (ecuación 7.4).
A = abc (7.4)
Donde:
A= Absorbancia
c= Concentración de la especie absorbente
b= Trayectoria a través de la solución (cm)
a= Capacidad de absorción
No hay unidades asociadas con la absorbancia (A), ya que es el registro de una relación de potencias del haz. El término de concentración (c), puede expresarse en cualquier unidad apropiada (M, mM, mg/ml,%). La longitud de la trayectoria (b), está en unidades de cm. La capacidad de absorción (a) de una especie dada es una constante de proporcionalidad que depende de las propiedades moleculares de la especie. La capacidad de absorción depende de la longitud de onda y puede variar según el entorno químico (pH, fuerza iónica, disolvente, etc.) que experimenta la especie absorbente. Las unidades del término de absorción son (cm)-1(concentración)-1. En el caso especial donde la concentración del analito se informa en unidades de molaridad, el término de absorción tiene unidades de (cm)-1 (M)-1. En estas condiciones, se designa con el símbolo ε, que se denomina coeficiente de absorción molar. La ley de Beer expresada en términos del coeficiente de absorción molar se da en la ecuación. 7.5. En este caso, c se refiere específicamente a la concentración molar del analito:
A = εbc (7.5)
Donde:
A y b =son iguales que en la ecuación 7.4
E= Coeficiente de absorción molar
c= Concentración en unidades de molaridad
La espectroscopía cuantitativa depende de que el analista pueda medir con precisión la fracción de un haz de luz incidente que es absorbido por el analito en una solución dada. Esta tarea aparentemente simple es algo complicada en la práctica, debido a procesos distintos a la absorción por el analito que también resultan en disminuciones significativas en la potencia del haz incidente. Está claro que estos procesos deben tenerse en cuenta si es necesaria una estimación verdaderamente cuantitativa de la absorción del analito. En la práctica, se utiliza una celda de referencia para corregir estos procesos. Una celda de referencia es aquella que, en teoría, coincide exactamente con la celda de absorción de muestra, con la excepción de que no contiene analito. Las celdas de referencia a menudo se preparan llenando las celdas con agua, pero en realidad esto se define en función de la matriz de la muestra (solución de agua, etanol, etc). La celda de referencia se coloca en la trayectoria del haz de luz, y la potencia de la radiación que sale de la celda de referencia se mide y se toma como P0 para la celda de muestra. Este procedimiento supone que todos los procesos, excepto la absorción selectiva de radiación por parte del analito, son equivalentes para la muestra y las células de referencia. La absorbancia realmente medida en el laboratorio se aproxima a la ecuación 7.6.
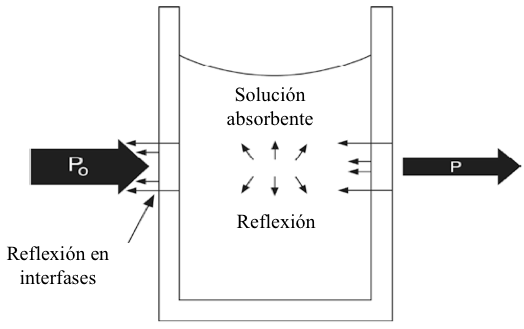
Figura 7.2 Factores que contribuyen a la atenuación de un haz de radiación a medida que pasa a través de una cubeta que contiene una solución absorbente.
A = log(Psolvent /P analyte solution 0)~ log(P0/P) (7.6)
Donde:
P solvente= Potencia radiante del haz que sale de la celda que contiene disolvente (blanco)
P solución del analito= Potencia radiante de la viga que sale de la celda que contiene solución de analito
7.2.2 Desviaciones de la ley de Beer[3]
Nunca se debe suponer que la ley de Beer se cumple estrictamente. De hecho, hay varias razones por las cuales la relación lineal predicha entre absorbancia y concentración puede no observarse. En general, la ley de Beer es aplicable solo a soluciones diluidas, hasta aproximadamente 10 mM para la mayoría de los analitos. La concentración real a la que la ley se vuelve limitante dependerá de la química del analito. A medida que aumenta la concentración del analito, las distancias intermoleculares en una solución de una muestra dada disminuirán, llegando finalmente a un punto en el que las moléculas vecinas afectan mutuamente la distribución de carga de la otra. Esta perturbación puede afectar significativamente la capacidad del analito para capturar fotones de una longitud de onda dada; es decir, puede alterar la capacidad de absorción del analito (a). Esto hace que la relación lineal entre concentración y absorción se rompa ya que el término de absorción es la constante de proporcionalidad en la ley de Beer. Otros procesos químicos también pueden dar lugar a desviaciones de la ley de Beer, como la asociación-disociación reversible de moléculas de analito o la ionización de un ácido débil en un solvente no tamponado. En cada uno de estos casos, la forma predominante del analito puede cambiar a medida que varía la concentración. Si las diferentes formas del analito (p. Ej., Ionizado versus neutro) tienen diferentes absorbancias (a), entonces no se observará una relación lineal entre la concentración y absorbancia.
Una fuente adicional de desviación de la ley de Beer puede surgir de las limitaciones en la instrumentación utilizada para las mediciones de absorbancia. La ley de Beer se aplica estrictamente a situaciones en las que la radiación que pasa a través de la muestra es monocromática, ya que en estas condiciones un solo valor de absorción describe la interacción del analito con toda la radiación que pasa a través de la muestra. Si la radiación que pasa a través de una muestra es policromática y existe una variabilidad en las constantes de absorción para las diferentes longitudes de onda constituyentes, entonces la ley de Beer no será obedecida. Un ejemplo extremo de este comportamiento ocurre cuando la radiación de la longitud de onda ideal y la radiación perturbante de una longitud de onda que el analito no absorbe en absoluto, atraviesan simultáneamente la muestra hacia el detector. En este caso, la transmitancia observada se definirá como en la ecuación. 7.7. Tenga en cuenta que se alcanzará un valor límite de absorbancia como Ps >> P, que ocurrirá a concentraciones relativamente altas del analito:
A = log(P0 +Ps)/ (P / Ps) (7.7)
Donde:
Ps=Poder radiante de la luz
A= Revisar ecuación 7.3
P y P0= Revisar ecuación 7.1
7.2.3 Consideraciones de procedimiento
El objetivo de muchas mediciones cuantitativas es determinar la concentración de un analito con una precisión y exactitud óptimas, en un tiempo mínimo y a un costo mínimo. Para lograr esto, es esencial que el analista considere los posibles errores asociados con cada paso en un ensayo particular. Las posibles fuentes de error para ensayos espectroscópicos incluyen técnicas de preparación de muestra inapropiadas, controles inapropiados, ruido instrumental y errores asociados con condiciones inapropiadas para mediciones de absorbancia (como lecturas extremas de absorbancia/transmitancia).
Los esquemas de preparación de muestras para mediciones de absorbancia varían considerablemente. En el caso más simple, la solución que contiene al analito puede medirse directamente después de la homogeneización y la clarificación. Excepto en casos especiales, se requiere homogeneización antes de cualquier análisis para garantizar una muestra representativa. La clarificación de las muestras es esencial antes de tomar las lecturas de absorbancia para evitar la absorción aparente debido a la dispersión de la luz por soluciones turbias.
La solución de referencia para muestras, en este caso más simple, será el solvente de muestra, el solvente es agua o un tampón acuoso en muchos casos. En situaciones más complejas, el analito a cuantificar puede necesitar ser modificado químicamente antes de realizar mediciones de absorbancia. En estos casos, el analito que no absorbe la radiación en un rango espectral apropiado se modifica específicamente, lo que da como resultado una especie con características de absorción compatibles con una medición espectrofotométrica dada. Se utilizan reacciones específicas como estas en muchos ensayos colorimétricos que se basan en la absorción de radiación en el rango de Vis. La solución de referencia para estos ensayos se prepara tratando el disolvente de la muestra de manera idéntica a la de la muestra. Por lo tanto, la solución de referencia ayudará a corregir cualquier absorbancia debido a los reactivos modificadores mismos y no al analito modificado.
Se debe elegir una cubeta o cubeta para contener muestras después de que se haya determinado la región espectral general que se utilizará en una medición espectrofotométrica. Las celdas que contienen muestras varían en composición y dimensiones. La celda que contiene la muestra debe estar compuesta de un material que no absorba la radiación en la región espectral que se utilizará. Las celdas que cumplen con este requisito para mediciones en el rango UV pueden estar compuestas de cuarzo o sílice fundida. Para la gama Vis, las celdas hechas de vidrio de silicato son apropiadas, y las celdas de plástico de bajo costo también están disponibles para algunas aplicaciones. Las dimensiones de la celda serán importantes con respecto a la cantidad de solución requerida para una medición y con respecto al término de longitud de ruta utilizado en la ley de Beer. Una celda de absorción típica tiene 1 cm2 de ancho y aproximadamente 4.5 cm de largo. La longitud de la ruta para esta celda tradicional es de 1 cm, y el volumen mínimo de solución necesario para las mediciones de absorción estándar es de aproximadamente 1,5 ml. Las celdas de absorción con longitudes de trayectoria que varían de 1 a 100 mm están disponibles comercialmente. También están disponibles celdas estrechas, de aproximadamente 4 mm de ancho, con longitudes de trayectoria óptica de 1 cm. Estas celdas estrechas son convenientes para las mediciones de absorbancia cuando están disponibles cantidades limitantes de solución, por ejemplo, menos de 1 ml.
En muchos casos, un analista debe elegir una longitud de onda adecuada a la que realizar las mediciones de absorbancia. Si es posible, es mejor elegir la longitud de onda a la que el analito demuestra la absorbancia máxima y donde la absorbancia no cambia rápidamente con los cambios en la longitud de onda.
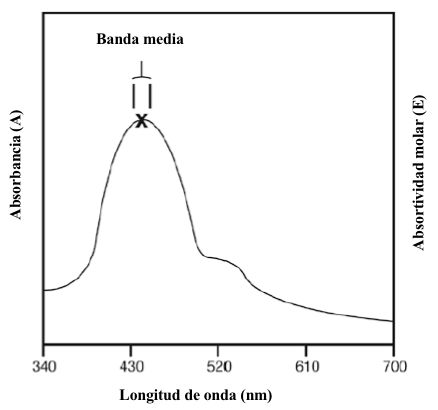
Figura 7.3 Espectro de absorción hipotético entre 340 y 700 nm. Suponiendo que el ancho de banda efectivo de la radiación utilizada para obtener el espectro es de aproximadamente 20 nm. Tenga en cuenta que en el punto indicado no hay esencialmente ningún cambio en la capacidad de absorción molar en este rango de longitud de onda.
Esta posición generalmente corresponde al vértice del pico de absorción más alto. Tomar medidas en este vértice tiene dos ventajas: (1) sensibilidad máxima, definida como el cambio de absorbancia por cambio de unidad en la concentración de analito, y (2) mayor ajuste a la ley de Beer, ya que la región espectral que compone el haz de radiación está compuesta de longitudes de onda con diferencias relativamente pequeñas en sus absorciones molares para el analito está siendo medido. El último punto es importante porque el haz de radiación utilizado en el análisis estará compuesto por una pequeña banda continua de longitudes de onda centrada alrededor de la longitud de onda indicada en el selector de longitud de onda del instrumento.
La medición real de la absorbancia se realiza calibrando primero el instrumento para 0% y luego 100% de transmitancia. El ajuste de transmitancia del 0% se realiza mientras el fotodetector se protege de la radiación incidente por medio de un obturador oclusivo, imitando una absorción infinita. Este ajuste establece la corriente de nivel base o "corriente oscura" en el nivel apropiado, de modo que la lectura indica cero. El ajuste del 100% de transmitancia se realiza con el obturador oclusivo abierto y una celda/solución de referencia apropiada en la trayectoria de la luz. La celda de referencia en sí misma debería ser equivalente a la celda que contiene la muestra (es decir, se utiliza un conjunto de celdas "coincidentes"). En muchos casos, se usa la misma celda tanto para la muestra como para las soluciones de referencia. La celda de referencia generalmente está llena de solvente, que a menudo es agua destilada/desionizada para sistemas acuosos. El ajuste del 100% T establece efectivamente T = 1 para la celda de referencia, lo que equivale a definir P0en la ecuación. 7.1 como equivalente a la potencia radiante del haz que sale de la celda de referencia. Los ajustes de 0% T y 100% T deben realizarse según sea necesario durante todo el ensayo. La celda de muestra que contiene al analito se mide sin cambiar los ajustes. Los ajustes realizados con la celda de referencia configurarán efectivamente el instrumento, para proporcionar una lectura de muestra en términos de la ecuación. 7.6. La lectura de la muestra de la solución estará entre 0 y 100% T. La mayoría de los espectrofotómetros modernos permiten al analista realizar mediciones de lectura en unidades de absorbancia o como porcentaje de transmitancia. Generalmente es más conveniente hacer lecturas en unidades de absorbancia ya que, en condiciones óptimas, la absorbancia es directamente proporcional a la concentración. Al realizar mediciones con un instrumento que emplea un tipo de lectura analógica de aguja oscilante, puede ser preferible usar la escala de porcentaje de transmitancia lineal y luego calcular la absorbancia correspondiente usando la ecuación. 7.3. Esto es particularmente cierto para mediciones en las que el porcentaje de transmitancia es menor que 20.
7.2.4 Curvas de calibración
En general, es aconsejable utilizar curvas de calibración para mediciones cuantitativas. Los ensayos empíricos que requieren el uso de una curva de calibración son comunes en los análisis de alimentos. La curva de calibración se usan para establecer la relación entre la concentración de analito y la absorbancia. Esta relación se establece experimentalmente a través del análisis de una serie de muestras de concentración de analito conocida. Las soluciones estándar se preparan mejor con los mismos reactivos y al mismo tiempo que los desconocidos. El rango de concentración cubierto por las soluciones estándar debe incluir el esperado para las soluciones de concentración desconocida. Se esperan curvas de calibración lineal para aquellos sistemas que obedecen la ley de Beer. Las curvas de calibración no lineales se utilizan para algunos ensayos, pero generalmente se prefieren las relaciones lineales debido a la facilidad de procesamiento de los datos. Las curvas de calibración no lineales pueden deberse a cambios dependientes de la concentración en la química del sistema o a limitaciones inherentes a los instrumentos utilizados para el ensayo. La curva de calibración no lineal en la figura 7.4b refleja el hecho de que la sensibilidad de calibración, definida como el cambio en la absorbancia por unidad de cambio en la concentración de analito, no es constante.
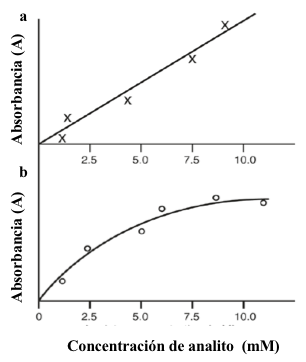
Figura 7.4 Curvas de calibración lineal (a) y no lineal (b) típicamente encontradas en la espectroscopía de absorción cuantitativa.
En muchos casos, los estándares de calibración verdaderamente representativos no se pueden preparar debido a la complejidad de la muestra desconocida. Se debe suponer este escenario cuando no hay suficiente información disponible sobre el alcance de los compuestos que interfieren en lo desconocido. Los compuestos que interfieren incluyen aquellos que absorben radiación en la misma región espectral que el analito, aquellos que influyen en la absorbancia del analito y aquellos compuestos que reaccionan con reactivos modificadores que supuestamente son específicos para el analito. Esto significa que las curvas de calibración son potencialmente erróneas si lo desconocido y los estándares difieren con respecto al pH, la fuerza iónica, la viscosidad, los tipos de impurezas y similares. En estos casos, es aconsejable calibrar el sistema de ensayo utilizando un protocolo de adición estándar. Uno de estos protocolos es el siguiente: a una serie de matraces, agregue un volumen constante de lo desconocido (Vu) para el que está tratando de determinar la concentración de analito (Cu). A continuación, a cada matraz individual, agregue un volumen conocido (Vs) de una solución de analito estándar de concentración Cs, de modo que cada matraz reciba un volumen único de estándar. La serie resultante de matraces contendrá volúmenes idénticos de los volúmenes desconocidos y diferentes de la solución estándar. A continuación, diluya todos los matraces al mismo volumen total, Vt. Cada uno de los matraces se ensaya,cada matraz tratado de manera idéntica. Si se obedece la ley de Beer, la absorbancia medida de cada matraz será proporcional a la concentración total de analito como se define en la ecuación. 7.8.
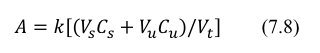
Donde:
Vs= Volumen estándar
Vu= Volumen desconocido
Vt=Volumen total
Cs= Concentración del estándar
Cu= Concentración desconocida
K= Constante de proporcionalidad (capacidad de absorción x)
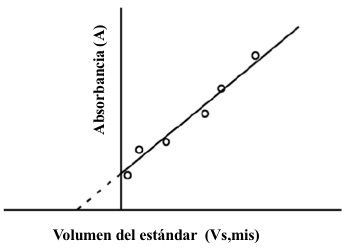
Figura 7.5 Curva de calibración para la determinación de la concentración de analito en una solución desconocida utilizando un protocolo de adición estándar. A absorbancia, Vs volumen de solución de analito estándar; como se discutió en el texto.
Los resultados de los ensayos se grafican luego con el volumen del estándar agregado a cada matraz (Vs) como la variable independiente y la absorbancia resultante (A) como la variable dependiente (Fig. 7.5). Asumiendo la ley de Beer, la línea que describe la relación será como en la ecuación 7.9, en el que todos los términos que no sean Vs y A sean constantes. Tomando la relación de la pendiente de la línea trazada (Ec. 7.10) a la intersección de la línea (Ec. 7.11) y reorganizando se obtiene la Ec. 7.12, a partir de la cual se puede calcular la concentración de lo desconocido, Cu, ya que Cs y Vu son constantes definidas experimentalmente:

7.2.5 Efecto del error instrumental indiscriminado en la precisión de las mediciones de absorción
Todos los ensayos espectrofotométricos tendrán cierto nivel de error indiscriminado asociado con la medición de absorbancia/transmitancia en sí. El error indiscriminado de este tipo a menudo se denomina ruido del instrumento. Es importante que el ensayo se diseñe de manera que se minimice esta fuente de error, con el objetivo de mantener esta fuente de error baja en relación con la variabilidad asociada con otros aspectos del ensayo, como la preparación de muestras, el submuestreo, el manejo de reactivos y todo lo implicado en el proceso. Se observa un error instrumental indiscriminado con mediciones repetidas de una sola muestra homogénea. La incertidumbre relativa de la concentración resultante de este error no es constante en todo el rango de transmitancia porcentual (0–100%). Las mediciones de valores de transmitancia intermedios tienden a tener errores relativos más bajos, por lo tanto, son de mayor precisión relativa, que las mediciones realizadas con transmitancia muy alta o muy baja. La incertidumbre de concentración relativa o el error relativo pueden definirse como Sc/C, donde Sc es la desviación estándar de la muestra y C es la concentración medida. Se pueden esperar incertidumbres de concentración relativa de 0.5% a 1.5% para las mediciones de absorbancia/transmitancia tomadas en el rango óptimo. El rango óptimo para las mediciones de absorbancia en espectrofotómetros simples y menos costosos es de aproximadamente 0.2 a 0.8 unidades de absorbancia, o 15 a 65% de transmitancia. En instrumentos más sofisticados, el rango para las lecturas de absorbancia óptimas puede extenderse hasta 1.5 o más. Para estar seguros, es prudente hacer siempre lecturas de absorbancia en condiciones en las que la absorbancia de la solución de analito sea inferior a 1,0. Si existe una necesidad anticipada de realizar mediciones con lecturas de absorbancia mayores a 1.0, entonces la precisión relativa del espectrofotómetro debe establecerse experimentalmente mediante mediciones repetitivas de muestras apropiadas. Se pueden usar lecturas de absorbancia fuera del rango óptimo del instrumento, pero el analista debe estar preparado para tener en cuenta el error relativo más alto asociado con estas lecturas extremas. Cuando las lecturas de absorbancia se acercan a los límites de la instrumentación, es posible que no se detecten diferencias relativamente grandes en las concentraciones de analito.
7.2.6 Instrumentación
Hay una variedad de espectrofotómetros disponibles para la espectrofotometría UV-Vis. Algunos instrumentos están diseñados para funcionar solo en el rango visible, mientras que otros abarcan los rangos UV y Vis. Los instrumentos pueden diferir con respecto al diseño, calidad de los componentes y la versatilidad. Un espectrofotómetro básico se compone de cinco componentes esenciales: la fuente de luz, el monocromador, el soporte de muestra/referencia, el detector de radiación y un dispositivo de lectura. Se requiere una fuente de alimentación para el funcionamiento del instrumento.
7.2.6.1 Fuente de luz
Las fuentes de luz utilizadas en los espectrofotómetros deben emitir continuamente una fuerte banda de radiación que abarque todo el rango de longitud de onda para el que está diseñado el instrumento. La potencia de la radiación emitida debe ser suficiente para una respuesta adecuada del detector, y no debe variar bruscamente con los cambios en la longitud de onda o la deriva significativa en la escala de tiempo experimental. La fuente de radiación más común para los espectrofotómetros Vis es la lámpara de filamento de tungsteno. Estas lámparas emiten una radiación adecuada que cubre la región de longitud de onda de 350 a 2,500 nm. En consecuencia, las lámparas de filamento de tungsteno también se emplean en espectroscopía de infrarrojos cercanos. Las fuentes de radiación más comunes para mediciones en el rango UV son las lámparas de descarga eléctrica de deuterio. Estas fuentes proporcionan un espectro de radiación continuo de aproximadamente 160 nm a 375 nm. Estas lámparas emplean ventanas de cuarzo y deben usarse junto con soportes de muestra de cuarzo, ya que el vidrio absorbe significativamente la radiación por debajo de 350 nm.
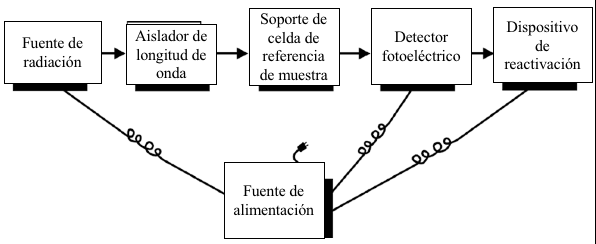
Figura 7.6 Disposición de componentes en un espectrofotómetro simple de absorción UV-Vis.
7.2.6.2 Monocromador
El componente que funciona para aislar el grupo específico, estrecho y continuo de longitudes de onda que se utilizarán en el ensayo espectroscópico es el monocromador. El monocromador se llama así porque la luz de una sola longitud de onda se denomina monocromática. Teóricamente, la radiación policromática de la fuente ingresa al monocromador y se dispersa de acuerdo con la longitud de onda, y la radiación monocromática de una longitud de onda seleccionada sale del monocromador. En la práctica, la luz que sale del monocromador no es de una sola longitud de onda, sino que consiste en una banda estrecha y continua de longitudes de onda. Como se ilustra en la Figura 7.7, un monocromador típico está compuesto por rendijas de entrada y salida, espejo (s) cóncavo (s) y un elemento dispersante (la rejilla en este ejemplo particular). La luz policromática ingresa al monocromador a través de la ranura de entrada y luego es culminada por un espejo cóncavo. La radiación policromática culminada se dispersa luego, siendo la dispersión la separación física en el espacio de radiación de diferentes longitudes de onda. La radiación de diferentes longitudes de onda se refleja desde un espejo cóncavo que enfoca las diferentes longitudes de onda de la luz secuencialmente a lo largo del plano focal. La radiación que se alinea con la ranura de salida en el plano focal se emite desde el monocromador. La radiación que emana del monocromador consistirá en un rango estrecho de longitudes de onda presumiblemente centradas alrededor de la longitud de onda especificada en el control de selección de longitud de onda del instrumento.
El tamaño del rango de longitud de onda que sale de la ranura de salida del monocromador se denomina ancho de banda de la radiación emitida. Muchos espectrofotómetros permiten al analista ajustar el tamaño de la ranura de salida del monocromador (y la ranura de entrada) y, en consecuencia, el ancho de banda de la radiación emitida.
Disminuir el ancho de la ranura de salida disminuirá el ancho de banda asociado y la potencia radiante del haz emitido. Por el contrario, una mayor apertura de la ranura de salida dará como resultado un haz de mayor potencia radiante pero que tiene un ancho de banda mayor.
En algunos casos donde la resolución es crítica, como algunos trabajos cualitativos, se puede recomendar un ancho de ranura más estrecho. Sin embargo, en la mayoría de los trabajos cuantitativos, se puede usar una ranura relativamente abierta ya que los picos de adsorción en el rango de UV-Vis generalmente son amplios en relación con los anchos de banda espectrales. Además, la relación señal/ruido asociada con las mediciones de transmitancia se mejora debido a la mayor potencia radiante del haz medido.
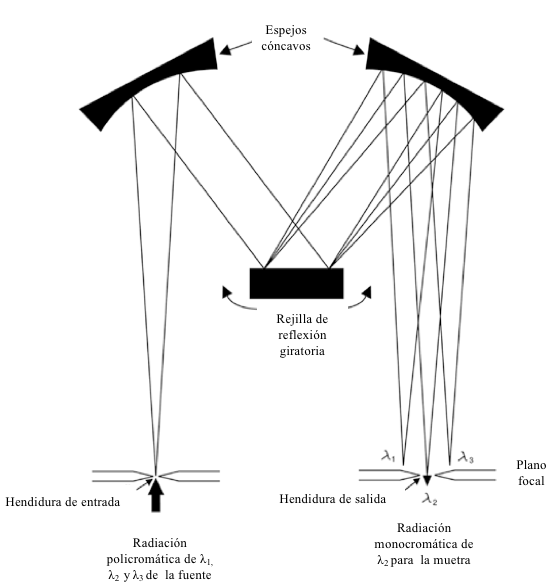
Figura 7.7 Esquema de un monocromador que emplea una rejilla de reflexión como elemento dispersante. Los espejos cóncavos sirven para culminar la radiación en un haz de rayos paralelos.
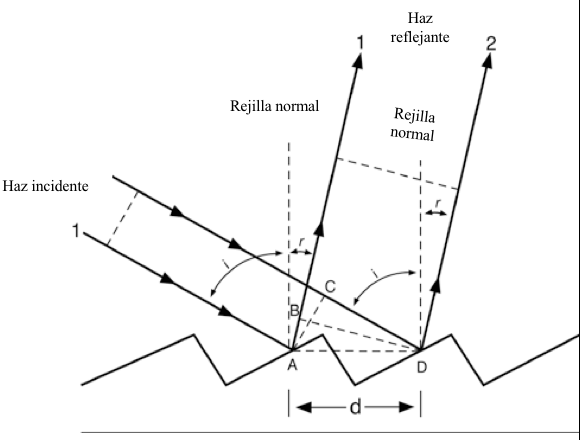
Figura 7.8 Esquema que ilustra la propiedad de difracción de una rejilla de reflexión. Cada fuente puntual reflejada de radiación está separada por una distancia d.
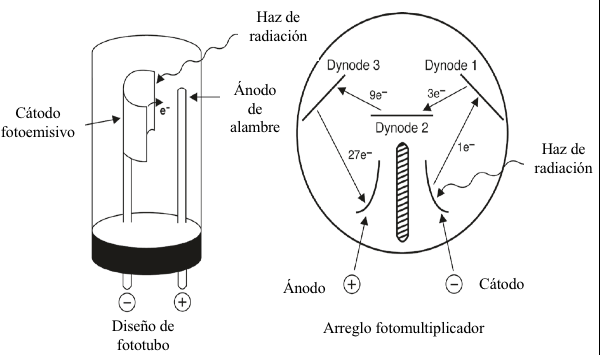
Figura 7.9 Diagrama esquemático de un diseño típico de fototubos (a) y la disposición cátodo-dynode-ánodo de un tubo fotomultiplicador representativo (b).
Los detectores de fotodiodos ahora son comunes en los espectrofotómetros UV-Vis. Estos son dispositivos de estado sólido en los que la señal eléctrica inducida por la luz es el resultado de fotones que excitan electrones en los materiales semiconductores a partir de los cuales están fabricados, más comúnmente de silicio. Los espectrofotómetros que usan detectores de fotodiodos pueden contener un solo detector de diodos o una matriz lineal de diodos (espectrofotómetros de matriz de diodos). Si se usa un solo detector de fotodiodo, entonces la disposición de los componentes es generalmente como ilustra la Figura 7.6. Si se utiliza un conjunto de detectores de fotodiodos, la luz que se origina en la fuente generalmente pasa a la muestra antes de que se disperse. La luz transmitida a través de la muestra se dispersa posteriormente en la matriz de diodos, y cada diodo mide una banda estrecha del espectro resultante. Este diseño permite medir simultáneamente múltiples longitudes de onda, lo que permite la recolección casi instantánea de un espectro de absorción completo. Los detectores basados ??en diodos generalmente son más sensibles que los fototubos pero menos sensibles que los tubos fotomultiplicadores.
7.2.6.4 Dispositivo de lectura
La señal del detector generalmente se amplifica y luego se muestra de forma utilizable al analista. La forma final en la que se muestra la señal dependerá de la complejidad del sistema. En el caso más simple, la señal analógica del detector se muestra en un medidor analógico a través de la posición de una aguja en una cara del medidor calibrada en porcentaje de transmisión o absorbancia. Las lecturas analógicas son adecuadas para la mayoría de los propósitos analíticos de rutina; sin embargo, los medidores analógicos son algo más difíciles de leer y, por lo tanto, se espera que los datos resultantes tengan una precisión algo menor que la obtenida en una lectura digital (suponiendo que la lectura digital se dé en suficientes lugares). Las lecturas digitales expresan la señal como números en la cara de un medidor. En estos casos, existe un requisito obvio para el procesamiento de la señal entre la salida analógica del detector y la pantalla digital final. En prácticamente todos los casos, el procesador de señal es capaz de presentar la lectura final en términos de absorbancia o transmitancia. Muchos de los instrumentos más nuevos incluyen microprocesadores capaces de manipulaciones de datos más extensos en la señal digitalizada. Por ejemplo, las lecturas de algunos espectrofotómetros pueden estar en unidades de concentración, siempre que el instrumento haya sido calibrado correctamente con los estándares de referencia apropiados.
7.2.7 Diseño de instrumentos
Los sistemas ópticos de los espectrofotómetros se dividen en una de dos categorías generales: son instrumentos de un solo haz o de doble haz. En un instrumento de un solo haz, el haz radiante sigue un solo camino, que va desde la fuente a través de la muestra hasta el detector. Cuando se usa un instrumento de un solo haz, el analista generalmente mide la transmitancia de una muestra después de establecer primero 100% T, o P0, con una muestra de referencia o blanco. El blanco y la muestra se leen secuencialmente ya que solo hay una única ruta de luz que atraviesa un compartimento de retención de celdas. En un instrumento de doble haz, el haz se divide de modo que la mitad del haz pasa a través de un compartimento de retención de celdas y la otra mitad del haz pasa a través de un segundo compartimiento de retención de celdas. El esquema de la Figura 7.10 ilustra un sistema óptico de doble haz en el que el haz se divide en el tiempo entre la muestra y la celda de referencia. En este diseño, el haz se pasa alternativamente a través de la muestra y las celdas de referencia por medio de un espejo de sector giratorio con sectores alternativos reflectantes y transparentes. El diseño de doble haz permite al analista medir y comparar simultáneamente la absorbancia relativa de una muestra y una celda de referencia. La ventaja de este diseño es que compensará las desviaciones o desviaciones en la salida radiante de la fuente, ya que la muestra y las celdas de referencia se comparan muchas veces por segundo. La desventaja del diseño de doble haz es que la potencia radiante del haz incidente disminuye porque el haz se divide. El rendimiento de energía más bajo del diseño de doble haz generalmente se asocia con relaciones señal/ruido inferiores. Los espectrofotómetros de haz simple computarizado ahora están disponibles y afirman tener los beneficios de los diseños de haz simple y doble. Sus fabricantes informan que los problemas de ruido y derivación de la fuente y el detector previamente problemáticos se han estabilizado de manera que no es necesaria la lectura simultánea de la celda de referencia y de la muestra. Con estos instrumentos, las celdas de referencia y de muestra se leen secuencialmente y los datos se almacenan, y luego se procesan en la computadora asociada.
El Spectronic ®20 es un ejemplo clásico de un epectrofotómetro de luz visible de un solo haz (Figura 7.11). La luz blanca emitida por la fuente pasa al monocromador a través de su ranura de entrada; la luz se dispersa en un espectro mediante una rejilla de difracción, y una parte del espectro resultante abandona el monocromador a través de la ranura de salida. La radiación emitida por el monocromador pasa a través de un compartimento de muestra e impacta al detector de fotodiodo de silicio, lo que resulta en una señal eléctrica proporcional a la intensidad de la luz que incide. Las lentes representadas en la Figura 7.11 funcionan en serie para enfocar la imagen de luz en el plano focal que contiene la ranura de salida. Para cambiar la porción del espectro que sale del monocromador, se gira la rejilla reflectora por medio de la leva de longitud de onda. Un obturador bloquea automáticamente la salida de luz del monocromador cuando no hay una celda de muestra/referencia en el instrumento; el ajuste de cero por ciento T se realiza bajo estas condiciones. El oclusor de control de luz se utiliza para ajustar la potencia radiante del haz que sale del monocromador. El oclusor consiste en una tira opaca con una abertura en forma de V que se puede mover físicamente dentro o fuera de la trayectoria del haz. El oclusor se usa para realizar el ajuste del 100% T cuando hay una celda de referencia apropiada en el instrumento.
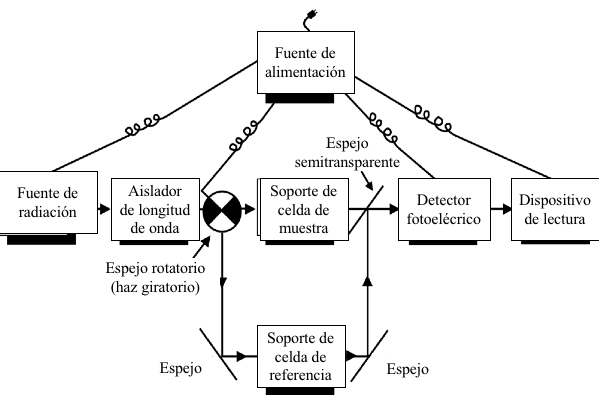
Figura 7.10 Disposición de componentes en un espectrofotómetro de absorción UV-Vis de doble haz representativo. El haz incidente se pasa alternativamente a través de la muestra y las celdas de referencia por medio de un cortador de haz giratorio.
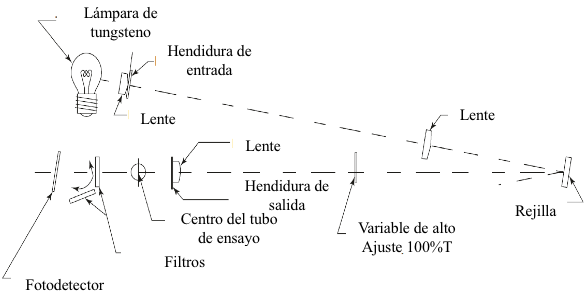
Figura 7.11 Sistema óptico del Espectrofotómetro Spectronic® 20.
7.2.8 Características de las especies absorbentes de UV-Vis
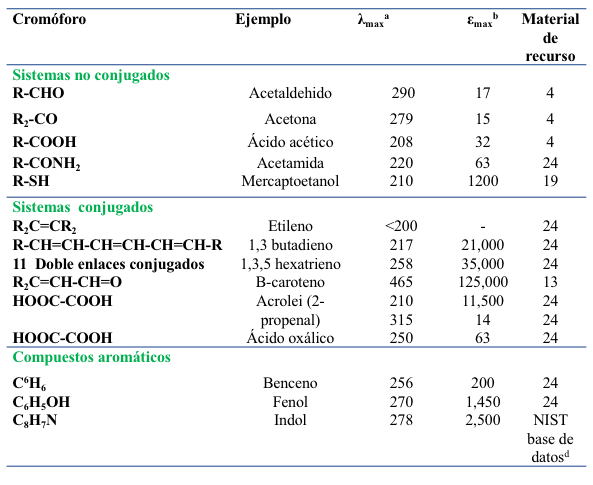
La absorbancia de la radiación UV-Vis está asociada con excitaciones electrónicas dentro de átomos y moléculas. Los métodos analíticos comúnmente encontrados basados en la espectroscopía UV-Vis no usan radiación UV por debajo de 200 nm. Por lo tanto, las excitaciones de interés en la espectroscopía UV-Vis tradicional son el resultado de la insaturación y/o la presencia de electrones no unidos en las moléculas absorbentes. Las características de absorción UV-Vis de varios grupos funcionales comunes a los componentes de los alimentos se presentan en la Tabla 7.2. Las longitudes de onda presentadas de absorbancia máxima y los coeficientes de absorción molar asociados son solo aproximados, ya que el entorno al que está expuesto el grupo funcional, incluidos los constituyentes y disolventes vecinos, influirá en las propiedades electrónicas del grupo funcional.
El tipo de información contenida en la Tabla 7.2 probablemente será útil para determinar la viabilidad de la espectroscopía UV-Vis para aplicaciones específicas. Por ejemplo, es útil conocer las características de absorción de los grupos carboxilo si se considera la posibilidad de utilizar la espectroscopía de absorción UV-Vis como método de detección para controlar los ácidos orgánicos no derivados que se eluyen de las columnas de cromatografía líquida. Con respecto a esta pregunta particular de ácidos orgánicos, la tabla indica que es probable que los ácidos orgánicos absorban radiación en el rango accesible para la mayoría de los detectores UV-Vis (> 200 nm). Sin embargo, la Tabla también indica que es probable que la sensibilidad de dicho método de detección se vea limitada debido al bajo coeficiente de absorción molar de los grupos carboxilo a tales longitudes de onda. Esto explica por qué los métodos de cromatografía líquida de alto rendimiento para la cuantificación de ácidos orgánicos a veces utilizan videtectores UV ajustados a ~ 210 nm (p. Ej., Material de recurso 3), y por qué hay esfuerzos de investigación destinados a desarrollar métodos de derivatización para mejorar la sensibilidad de los rayos UV en Métodos basados en Vis para la cuantificación de ácidos orgánicos.
Los datos de la tabla 7.2 también ilustran el efecto de la conjugación en las transiciones electrónicas. El aumento de la conjugación conduce a máximos de absorción en longitudes de onda más largas debido a la disminución asociada en el espacio de energía electrónica dentro de un sistema conjugado (es decir, una menor diferencia de energía entre el estado fundamental y el estado excitado). Los compuestos aromáticos incluidos en la tabla se eligieron debido a su relevancia para la cuantificación de proteínas: benceno/fenilalanina, fenol/tirosina e indol/triptófano. La tabla indica que las proteínas típicas tendrán un máximo de absorción a aproximadamente 278 nm (alto coeficiente de absorción molar de la cadena lateral de indol del triptófano), así como otro pico a aproximadamente 220 nm. Este último pico corresponde a los enlaces amida/péptido a lo largo del esqueleto de la proteína, deduciéndose la razón de los datos para la amida simple incluida en la tabla (es decir, acetamida).
Tabla 7.2 Máximos de absorción representativos por encima de 200 nm para grupos funcionales seleccionados.
7.3 Espectroscopía de fluorescencia
La espectroscopía de fluorescencia es generalmente de uno a tres órdenes de magnitud más sensible que la espectroscopía de absorción correspondiente. En la espectroscopía de fluorescencia, la señal que se mide es la radiación electromagnética que se emite desde el analito a medida que se relaja desde un nivel de energía electrónica excitado hasta su estado fundamental correspondiente. El analito se activa originalmente al nivel de energía más alto por la absorción de radiación en el rango UV o Vis. Los procesos de activación y desactivación ocurren simultáneamente durante una medición de fluorescencia. Para cada sistema molecular único, habrá una longitud de onda de radiación óptima para la excitación de la muestra y otra, de mayor longitud de onda, para controlar la emisión de fluorescencia. Las respectivas longitudes de onda para la excitación y la emisión dependerán de la química del sistema en estudio.
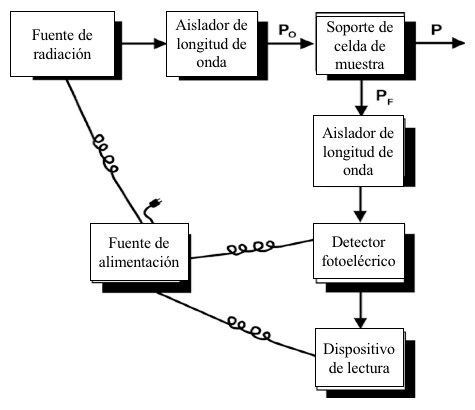
Figura 7.12 Diagrama esquemático que representa la disposición de la fuente, los selectores de longitud de onda de excitación y emisión, la celda de muestra, el detector fotoeléctrico y el dispositivo de lectura para un fluorómetro o espectrofluorómetro representativo.
La instrumentación utilizada en la espectroscopía de fluorescencia está compuesta esencialmente por los mismos componentes que la instrumentación correspondiente utilizada en la espectroscopía de absorción UV-Vis. Sin embargo, existen diferencias significativas en la disposición de los sistemas ópticos utilizados para los dos tipos de espectroscopía (comparar las Figuras 7.6 y 7.12). En fluorómetros y espectrofluorómetros, se necesitan dos selectores de longitud de onda, uno para el haz de excitación y otro para el haz de emisión. En algunos fluorómetros simples, ambos selectores de longitud de onda son filtros de manera que las longitudes de onda de excitación y emisión son fijas. En espectrofluorómetros más sofisticados, las longitudes de onda de excitación y emisión se seleccionan mediante monocromadores de rejilla. El detector de fotones de la instrumentación de fluorescencia está generalmente dispuesto de tal manera que la radiación emitida que incide en el detector se desplaza en un ángulo de 90° con respecto al eje del haz de excitación. Esta ubicación del detector minimiza la interferencia de la señal debido a la radiación de la fuente transmitida y la radiación dispersada de la muestra.
El poder radiante del haz de fluorescencia (PF) emitido por una muestra fluorescente es proporcional al cambio en el poder radiante del haz de la fuente a medida que pasa a través de la celda de muestra (Ec.7.13). Expresado de otra manera, la potencia radiante del haz de fluorescencia será proporcional al número de fotones absorbidos por la muestra:

La constante de proporcionalidad utilizada en la ecuación. 7.13 se denomina eficiencia cuántica (φ), que es específica para cualquier sistema dado. La eficiencia cuántica es igual a la relación entre el número total de fotones emitidos y el número total de fotones absorbidos. Combinando las ecuaciones 7.3 y 7.5 es asequible definir P en términos de la concentración del analito y P0, como se indica en la ecuación. 7.14:

La sustitución de la ecuación 7.14 en la ecuación. 7.13 da una expresión que relaciona la potencia radiante del haz fluorescente con la concentración de analito y P0, como se muestra en la ecuación. 7.15. A bajas concentraciones de analito, εbc <0.01, Ecuación 7.15, y puede reducirse a la expresión de la ecuación. 7.16 (ver Material de recursos 20 para más información sobre esto). Una mayor agrupación de términos conduce a la expresión de la ecuación. 7.17, donde k incorpora todos los términos que no sean P0 y c:

La ecuación 7.17 es particularmente útil porque enfatiza dos puntos importantes que son válidos para las condiciones asumidas al derivar la ecuación, particularmente el supuesto de que las concentraciones del analito se mantienen relativamente bajas. Primero, la señal fluorescente será directamente proporcional a la concentración de analito, suponiendo que otros parámetros se mantengan constantes. Esto es muy útil porque una relación lineal entre la señal y la concentración del analito simplifica el procesamiento de datos y la resolución de problemas del ensayo. En segundo lugar, la sensibilidad de un ensayo fluorescente es proporcional a P0, la potencia del haz incidente, lo que implica que la sensibilidad de un ensayo fluorescente puede modificarse ajustando la salida de la fuente. Las ecuaciones 7.16 y 7.17 eventualmente se descompondrán si las concentraciones del analito se incrementan a valores relativamente altos. Por lo tanto, el rango de concentración lineal para cada ensayo debe determinarse experimentalmente. En la figura 7.13 se presenta una curva de calibración representativa para un ensayo de fluorescencia. La porción no lineal de la curva a concentraciones de analito relativamente altas resulta de la disminución en el rendimiento de fluorescencia por unidad de concentración. El rendimiento de fluorescencia para cualquier muestra dada también depende de su entorno. La temperatura, el disolvente, las impurezas y el pH pueden influir en este parámetro. En consecuencia, es imperativo que estos parámetros ambientales se tengan en cuenta en el diseño experimental de los ensayos de fluorescencia. Esto puede ser particularmente importante en la preparación de estándares de referencia apropiados para el trabajo cuantitativo.
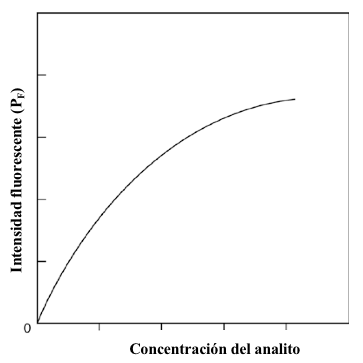
Figura 7.13 Relación entre la concentración de la solución de un analito fluorescente y la intensidad de fluorescencia de esa solución. Tenga en cuenta que existe una relación lineal a concentraciones del analito relativamente bajas que eventualmente no es lineal a medida que aumenta la concentración de analito.
Un ejemplo del uso de la espectroscopía de fluorescencia en la industria alimentaria es al detectar las señales de fluorescencia típicas inducidas por los compuestos fluorescentes presentes en los yogures, como la riboflavina (Rb) y la porfirina para evaluar la calidad del producto al exponerlos al aire ambiente. Los resultados demuestran que los espectros de fluorescencia tienen un gran potencial para predecir la calidad del yogur[4]. También se pueden detectar, por ejemplo, los cambios inducidos en la leche procesada después de la exposición a los rayos UV y luz blanca, empleando espectroscopía de fluorescencia. Para ello se puede monitorear la fotodegradación de Rb causado por la descomposición fotoquímica y fotosensibilización y la sensibilidad de la vitamina A causado a la exposición de la luz luz[5], dándonos conocimiento importante sobre la calidad de la leche. Otro ejemplo es comprender el efecto fotosensibilizador de la riboflavina frente a los tetrapirroles naturales en la leche de vaca al exponerla a luz azul (400-500 nm), que es absorbida por Rb y tetrapirroles, luz naranja (575-750 nm), que es absorbida por tetrapirroles pero no Rb, y luz blanca, que contiene toda la región visible. Mediante espectroscopía de fluorescencia se observa si los tetrapirroles se degradan más por la luz naranja que por la azul y si el grado de degradación se correlacionaba estrechamente con la formación de sabores desagradables sensoriales[6].
7.4 Resumen
La absorción de UV y Vis y la espectroscopía de fluorescencia se utilizan ampliamente en el análisis de alimentos. Estas técnicas pueden usarse para mediciones cualitativas o cuantitativas. Las mediciones cualitativas se basan en la premisa de que cada analito tiene un conjunto único de espacios de energía que determinarán su espectro de absorción/emisión. Por lo tanto, los ensayos cualitativos generalmente se basan en el análisis del espectro de absorción o emisión del analito. En contraste, los ensayos cuantitativos con mayor frecuencia se basan en la medición de la absorbancia o fluorescencia de la solución del analito a una longitud de onda particular. Los ensayos de absorción cuantitativa se basan en la premisa de que la absorbancia de la solución de prueba estará dada función de la concentración de analito de la solución.
En condiciones óptimas, existe una relación lineal directa entre la absorbancia de una solución y su concentración de analito. La ecuación que describe esta relación lineal se conoce como la ley de Beer. La aplicabilidad de la ley de Beer a cualquier ensayo dado siempre debe verificarse experimentalmente por medio de una curva de calibración. La curva de calibración debe establecerse al mismo tiempo y bajo las mismas condiciones que se utilizan para medir la solución de prueba. La concentración de analito de la solución de prueba deben estimarse a partir de la curva de calibración establecida.
Los métodos de fluorescencia molecular se basan en la medición de la radiación emitida por las moléculas de analito excitado a medida que se relajan para reducir los niveles de energía. Los analitos se elevan al estado excitado como resultado de la absorción de fotones. Los procesos de absorción de fotones y emisión de fluorescencia ocurren simultáneamente durante el ensayo. Los ensayos cuantitativos de fluorescencia son generalmente de uno a tres órdenes de magnitud más sensibles que los ensayos de absorción correspondientes. Al igual que los ensayos de absorción, en condiciones óptimas habrá una relación lineal directa entre la intensidad de fluorescencia y la concentración del analito en la solución desconocida. La mayoría de las moléculas no son fluorescentes y, por lo tanto, no pueden analizarse mediante métodos de fluorescencia. Los instrumentos utilizados para los métodos de absorción y fluorescencia tienen componentes similares, que incluyen una fuente de radiación, selector (es) de longitud de onda, celda (s) de retención de muestra, detector (es) de radiación y un dispositivo de lectura.
7.5 Preguntas de repaso
1. ¿Por qué es común usar valores de absorbancia en lugar de valores de transmitancia cuando se realiza una espectroscopía cuantitativa UV-Vis?
2. Para un ensayo particular, la gráfica de absorbancia versus concentración no es lineal; explica las posibles razones de esto.
3. ¿Qué criterios deberían usarse para elegir una longitud de onda apropiada para realizar las mediciones de absorbancia, y por qué es tan importante esa elección?.
4. En un ensayo particular, la lectura de absorbancia en el espectrofotómetro para una muestra es 2.033 y para otra muestra 0.032. ¿Confiarías en estos valores? ¿Por qué o por qué no?.
5. Explique la diferencia entre la radiación electromagnética en los rangos UV y Vis. ¿En qué se diferencia la espectroscopía cuantitativa con el rango UV de la que usa el rango Vis?.
6. ¿Qué está sucediendo realmente dentro del espectrofotómetro cuando el analista "establece" la longitud de onda para un ensayo en particular?.
7. Considerando un espectrofotómetro típico, ¿cuál es el efecto de disminuir el ancho de la ranura de salida del monocromador en la luz incidente a la muestra?.
8. Describa las similitudes y diferencias entre un fototubo y un tubo fotomultiplicador. ¿Cuál es la ventaja de uno sobre el otro?.
9. Su laboratorio ha estado usando un viejo espectrofotómetro de un solo haz que ahora debe ser reemplazado por un nuevo espectrofotómetro. Obtiene literatura de ventas que describe instrumentos de un solo un haz y de doble haz. ¿Cuáles son las diferencias básicas entre un espectrofotómetro de haz simple y uno de doble haz, y cuáles son las ventajas y desventajas de cada uno?.
10. Explique las similitudes y diferencias entre la espectroscopía UV-Vis y la espectroscopía de fluorescencia con respecto a la instrumentación y los principios involucrados. ¿Cuál es la ventaja de usar la espectroscopía de fluorescencia?.
7.6 Problemas prácticos
1. Un colorante alimentario particular tiene un coeficiente de absorción molar de 3.8 × 103cm−1M−1 a 510 nm.
(a) ¿Cuál será la absorbancia de una solución 2 × 10−4M en una cubeta de 1 cm a 510 nm?.
(b) ¿Cuál será el porcentaje de transmitancia de la solución en (a)?.
2. (a) Usted mide el porcentaje de transmitancia de una solución que contiene el cromóforo X a 400 nm en una cubeta de longitud de trayectoria de 1 cm y encuentra que es del 50%. ¿Cuál es la absorbancia de esta solución? (b) ¿Cuál es el coeficiente de absorción molar del cromóforo X si la concentración de X en la solución medida en la pregunta 2a es 0.5 mM? (c) ¿Cuál es el rango de concentración de cromóforo X que se puede analizar si, cuando se usa una celda de muestra de longitud de ruta 1, se requiere que mantenga la absorbancia entre 0.2 y 0.8?.
3. ¿Cuál es la concentración del compuesto Y en una solución desconocida si la solución tiene una absorbancia de 0.846 en una cubeta de vidrio con una longitud de trayectoria de 0.2 cm? La capacidad de absorción del compuesto Y es 54,2 cm−1 (mg/ml)-1 en las condiciones utilizadas para la medición de la absorción.
4. (a) ¿Cuál es el coeficiente de absorción molar del compuesto Z a 295 y 348 nm, dado el espectro de absorción que se muestra en la figura 7.14 (que se obtuvo usando un espectrofotómetro UV-Vis y una solución 1mM de compuesto Z en una muestra celda con una longitud de camino de 1 cm)? (b) Suponga que decide realizar mediciones cuantitativas de la cantidad de compuesto Z en diferentes soluciones. Según el espectro anterior, ¿qué longitud de onda usará para sus mediciones? Dé dos razones por las cuales esta es la longitud de onda óptima.
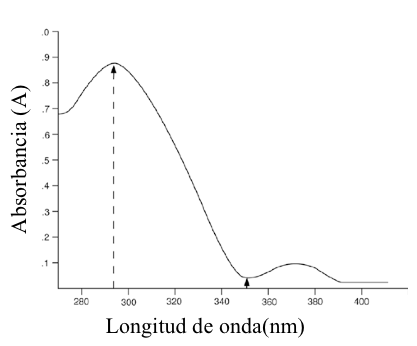
Figura 7.14 Espectro de absorción del compuesto Z, para ser usado junto con los problemas 4a y 4b.
Respuestas
- 1. (a) = 0.76, (b) = 17.4
- Este problema requiere un conocimiento de la relación entre absorbancia y transmitancia y la capacidad de trabajar con la ley de Beer.
Dado: El coeficiente de absorción molar = 3.8 × 103 cm−1M−1
(a) Use la ley de Beer: A = εbc (vea la ecuación 7.5 del texto)
donde:
ε= 3.8x103 cm-1 M-1
b= 1cm
c= 2x10-4M
Empleando la ley de Beer aparece la respuesta:
Absorbancia = 0.76
(b) Use la definición de absorbancia: A = −log T
(véase la ecuación 7.3 del texto)
dónde: T = P/P0
Reordenando la ecuación. 7.3:
-A=logT
10-A = T
A = 0,76 [de la parte (a) de la pregunta]
10-76=1737 =T
%T = 100xT
(combinando las ecuaciones 7.1 y 7.2 del texto)
La respuesta es: %T= 17.4
- 2. (a) = 301, (b) = 602 cm−1 M−1, (c) = 0.33 × 10−3M Para 1.33 × 10−3M
Este problema nuevamente requiere el conocimiento de la relación entre la absorbancia y la transmitancia y la manipulación de la ley de Beer. Se debe tener cuidado al trabajar con las unidades de concentración apropiadas.
- (a) T = 0.5
Usando A = -LogT = -Log.5 =.301
Respuesta: .301
- (b) Dado que la solución en la parte (a) es 0.5 mM (equivalente a 5 × 10−4M) Reorganizando la ley de Beer: ε = A/(bc)
Ε = .301/ [(1cm) x (5x10-4M)]
Respuesta = E=602cm-1 M-1
Para responder al problema, encuentre la concentración que dará una absorbancia de 0.200 (límite inferior) y la concentración que dará una absorbancia de 0.800 (límite superior). En ambos casos, use la ley de Beer para determinar las concentraciones apropiadas:
donde:
C = A/eb
Concentración mínima= 0.2/ [(602cm-1M-1) (1cm)]
=3.3 x 10-4 M (i.e., 1.33mM)
Concentracion máxima= 0.8/ [(602 cm-1M-1) (1cm)]
=1.3 x 10-3M (i.e., 1.33 mM)
- 3. 0.078 mg/ml
Este problema ilustra (1) que la concentración no necesita expresarse en unidades de molaridad y
(2) que la longitud de la cubeta debe tenerse en cuenta al aplicar la ley de Beer. En el presente problema, la concentración del analito se da en mg/ml: por lo tanto, la capacidad de absorción debe estar en unidades análogas:
Aplicando: c = A/e b
Donde:
A= 0.846
e = 54.2 cm-1 (mg/ml)-1
b = 0.2cm
Respuesta: 0.078mg/ml
4. (a) = 860 a 295 nm, 60 a 348 nm; (b) = 295 nm; sensibilidad óptima y más probabilidades de cumplir con la ley de Beer.
Este problema presenta la situación común en la que uno quiere usar la espectroscopía de absorbancia para mediciones cuantitativas pero no está seguro de qué longitud de onda elegir para las mediciones. Además, se desconoce la capacidad de absorción del analito en las diferentes longitudes de onda de interés. Una forma relativamente simple de obtener la información necesaria es determinar el espectro de absorción del analito a una concentración conocida.
(a) Las flechas en el espectro proporcionado indican los puntos en el espectro correspondientes a 295 y 348 nm. El problema señala que el espectro de absorción se obtuvo utilizando una solución 1 mM (es decir, una solución 1 × 10−3 M) del analito y que la longitud de la cubeta era de 1 cm. La respuesta al problema se determina entonces tomando la absorbancia del analito en las dos longitudes de onda en cuestión y luego conectando los datos apropiados en la ley de Beer. Es algo difícil obtener una lectura exacta de la absorbancia del espectro presentado, pero podemos estimar que la absorbancia de la solución 1 mM es ~ 0.86 a 295 nm y ~ 0.06 a 348 nm.
Usando ? = A / bc
Responder:
295nm e = 0.86/ [(1cm) (0.001M)]= 860 cm-1M-1
348nm e =0.06/ [(1cm) (.001M)]= 60cm-1M-1
(b) En general, los analistas se esfuerzan por obtener la máxima sensibilidad para sus ensayos, donde la sensibilidad se refiere al cambio en la señal de ensayo por unidad de cambio en la concentración de analito (la señal de ensayo en este caso es la absorbancia). Los valores de absorbancia para el analito en las diferentes longitudes de onda, tomados del espectro de absorción, y/o los valores de la capacidad de absorción relativa para el analito en las diferentes longitudes de onda, proporcionan una buena aproximación de la sensibilidad relativa del ensayo a diferentes longitudes de onda (es una aproximación porque no hemos determinado la variabilidad/precisión de las mediciones en las diferentes longitudes de onda) del espectro dado se puede ver que los "picos" de absorbancia estaban a ~ 298 y ~ 370 nm. Se espera que la sensibilidad del ensayo, en relación con las longitudes de onda vecinas, sea máxima en estos picos de absorbancia. El pico a 295 nm es significativamente mayor que el de 370 nm, por lo que se espera que la sensibilidad del ensayo sea significativamente mayor a 295 nm. Por lo tanto, esta sería la longitud de onda óptima para usar en el ensayo. Una segunda razón para elegir 295 nm es porque parece estar en el medio del "pico" y, por lo tanto, no se esperan pequeños cambios en la longitud de onda debido a limitaciones instrumentales/del operador que cambien apreciablemente los valores de absorción. Por lo tanto, es más probable que el ensayo cumpla con la ley de Beer. Hay situaciones en las que un analista puede optar por no usar la longitud de onda correspondiente a una absorbancia máxima general. Por ejemplo, si se sabe que hay compuestos interferentes que absorben a 295 nm, entonces un analista puede optar por tomar medidas de absorbancia a 370 nm.
[1] Dufour, Éric. (2011). Recent Advances in the Analysis of Dairy Product Quality Using Methods Based on the Interactions of Light with Matter. International Journal of Dairy Technology. 64. 153 - 165. 10.1111/j.1471-0307.2010.00665.x.
[2] Bosch-Ojeda, Catalina & Rojas, F.. (2009). Process Analytical Chemistry: Applications of Ultraviolet/Visible Spectrometry in Environmental Analysis: An Overview. Applied Spectroscopy Reviews. 44. 245-265. 10.1080/05704920902717898.
[3] Tissue, Brian. (2012). Ultraviolet and Visible Absorption Spectroscopy. 10.1002/0471266965.com059.pub2.
[4] Almeida, Mariana & Oliveira, Kamila & Sthephani, Rodrigo & De Oliveira, Luiz Fernando. (2012). Application of FT-Raman Spectroscopy and Chemometric Analysis for Determination of Adulteration in Milk Powder. Analytical Letters - ANAL LETT. 45. 10.1080/00032719.2012.698672.
[5] Iliut, Maria & FOCSAN, Monica & Astilean, Simion. (2013). MONITORING THE EFFECTS OF ULTRAVIOLET AND VISIBLE LIGHT ON Rb AND VITAMIN A IN MILK. Environmental engineering and management journal. 12. 2443-2448. 10.30638/eemj.2013.296.
[6] Airado-Rodríguez, Diego & Intawiwat, Natthorn & Skaret, Josefine & Wold, Jens. (2011). Effect of Naturally Occurring Tetrapyrroles on Photooxidation in Cow's Milk. Journal of agricultural and food chemistry. 59. 3905-14. 10.1021/jf104259p.
Autores:
Eduardo Ochoa Hernández
Nicolás Zamudio Hernández
Lizbeth Guadalupe Villalon Magallan
Mónica Rico Reyes
Pedro Gallegos Facio
Gerardo Sánchez Fernández
Rogelio Ochoa Barragán